Nat Cell Biol:研究揭示普通细胞预防癌症机制,或引发癌症防治新革命
2017-05-23 佚名 奇点网
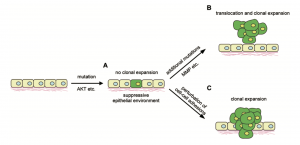
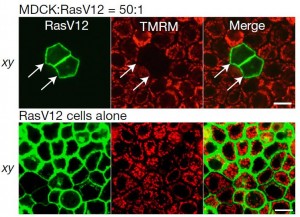
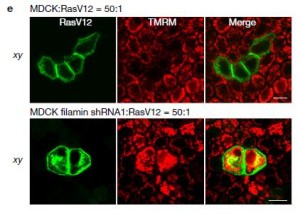
1970年代,西班牙科学家 Ginés Morata 和 Pedro Ripoll在果蝇的翅膀中发现了一个奇怪的现象。那些没有发生基因突变的普通细胞(注意!不是免疫细胞哦)会取代、消灭那些发生基因突变的细胞

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Bio#
36
#CEL#
35
#Biol#
34
#Cell#
36
#Nat#
38