JCO:“价廉”是否“物美”—— 曲妥珠单抗(赫赛汀)vs. 生物仿制药
2018-02-04 慧语 肿瘤资讯
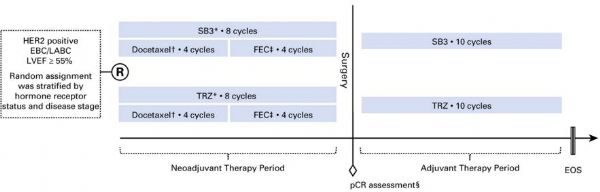
曲妥珠单抗(TRZ,商品名赫赛汀)是癌症治疗领域第一个分子靶向性药物,它是一种重组DNA衍生的人源化单克隆抗体,能够靶向作用于HER2(人表皮生长因子受体-2)的细胞外部位。赫赛汀于1998年获FDA批准上市, 2012年销售额突破60亿美元。然而任何新药都难逃专利到期的命运,2014年赫赛汀在欧洲和日本的专利到期,2015年在美国到期,专利到期,会促使大量的低价仿制药抢夺市场份额。继印度Bioc
作者:慧语
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#JCO#
42
#曲妥珠#
36
学习了谢谢分享!!
59
#仿制药#
31
#赫赛汀#
0