1 前言
机体每一个单个细胞的命运受其周围环境中存在的各种信号的影响,这些功能各异的信号被各种独立的细胞表面受体收集并传递给细胞质中复杂的信号处理通路。这些混杂的信号必须以某种方式处理、整合,并最终形成简单的、二元的命令,如决定细胞是继续增殖还是保持休眠。这些生物学行为提示,在细胞内部存在一些中央行动调节器,它们在细胞核中发挥细胞周期时钟的作用。
肿瘤细胞的增殖行为表明,细胞命运的主要调节器不仅受到正常蛋白质的影响,而且受到许多致癌基因编码蛋白的影响,它们参与到不同的信号通路中,破坏正常的细胞调控机制。同样,关键的抑癌基因的蛋白缺失也能导致调控通路的改变,因此,它们同样能影响细胞周期时钟的调控方向。
2 细胞周期
在有利于细胞指数生长的培养条件下,哺乳动物细胞展示出一个复杂的生长和分裂周期,即细胞周期。一个经过细胞分裂——有丝分裂和胞质分裂新近生成的子代细胞,必须马上决定是否进入下一个新的生长周期-分裂周期,或者退回到非生长状态,即G0期。
通过细胞分裂新近形成的细胞要维持在活跃的生长-分裂周期中,需要这些细胞即刻开始准备进入下一次分裂。这些准备必须包括细胞内大分子成分的复制和积累,这个过程涉及许多类型的分子,其中还包括细胞基因组的复制。
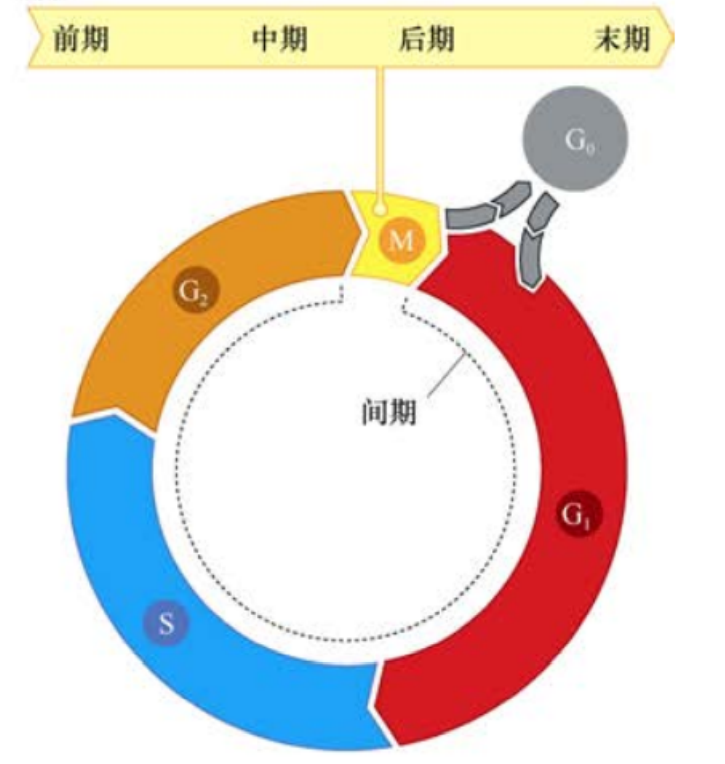
在大多数哺乳动物细胞中,细胞大分子的合成程序的差异非常大。RNA与蛋白质的累积在细胞分裂之后立即开始并且持续整个细胞分裂周期。与之不同的是,在细胞有丝分裂和胞质分裂形成子代细胞之后的几个小时内才开始DNA复制(12-15h)。这个子代细胞形成与DNA开始复制的间隙被命名为细胞周期的G1期。在这一时期里,细胞要作出继续生长还是维持静止的决定;对于静止细胞,则要决定细胞是否开始分化。这一关键的转换点被称为R点。
在许多培养的哺乳动物细胞中,G1期后的DNA合成通常需要6-8小时,这一DNA合成期被称为S期,这一时期的长度在一定程度上是由细胞内庞大的DNA含量所决定的。在此期内,DNA被精确复制。
经过S期后,细胞被认为应该直接进入有丝分裂期(M期)。然而,大多数哺乳动物细胞在进入M期之前都有一个3-5小时的延迟,这是细胞周期中的第二个间隙,称为G2期。在G2期,细胞为进入M期和细胞分裂做准备。
M期的完成通常大约需要1小时,包括4个独立的亚期:前期、中期、后期、末期,并最终完成胞质分裂,即细胞质的分离,形成两个新的子代细胞。
3 细胞周期的检验点
与所以的机制一样,细胞周期中每一步的执行都有可能发生故障,而细胞周期对细胞的重要作用要求细胞周期的每一步都准备无误。因此,细胞还需要具有一系列的监控机制来监督细胞周期的每一步,保证在上一步成功完成之后细胞周期才能进入下一步。这些监控机制被命名为检验点。

检验点强化了质量控制以保证细胞周期进入下一个循环前各时相的每一必需步骤都要准确完成。当细胞的基因组需要修复时,有一类检验点能够保证细胞不会从G1期进入S期;还有一类检验点能够在S期DNA的复制全部完成以前阻断细胞周期从G2期进入M期。DNA损伤能够触发某些检验点调控阻断细胞进入M期。在M期,高效能的检验点调控能够将细胞周期进程阻断在有丝分裂后期,直到所有染色体都附着到有丝分裂纺锤体上。
这些检验点的运行也影响肿瘤的形成。除了获得生长调控基因优势以外,许多肿瘤细胞还存在着一种或更多种检验点调控失活的情况。一旦这些调控机制发生松懈,初始肿瘤细胞中突变基因和异常核型的积累会更快,导致肿瘤加速生长。
4 细胞周期时钟的核心组件
当细胞信号通过信号调控蛋白向下游一些应答器传递时,信号经常是通过功能传递的蛋白激酶发挥作用的。参与细胞周期调控机制的蛋白激酶统称为细胞周期蛋白依赖性蛋白激酶(CDK),这些蛋白激酶不能依靠自身发挥作用,而必须依赖于调节亚单位——细胞周期蛋白的相互结合才能发挥正常功能。
CDK是丝氨酸/苏氨酸激酶,CDK之间具有40%的氨基酸序列同源性,因此它们形成了人类基因组编码的大约430个丝氨酸/苏氨酸激酶中的一个独特的亚家族。细胞周期蛋白与CDK的结合激活了激酶的催化活性。与此同时,细胞周期蛋白还具有导向作用,有助于细胞周期蛋白-CDK复合体在细胞中正确识别蛋白底物。细胞周期蛋白也共同组成了一个不同的细胞蛋白家族,它们都具有大约100个氨基酸残基所组成的相同结构域,参与CDK的集合和功能性活动。
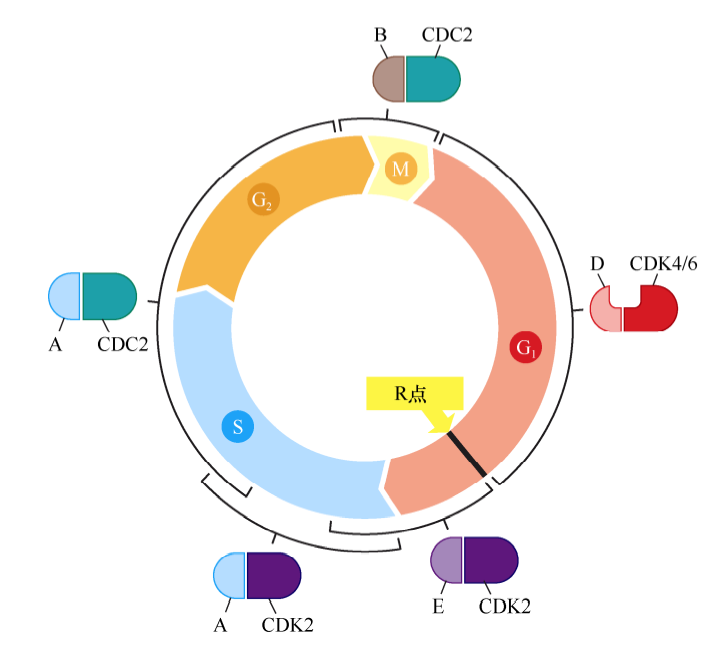
细胞周期蛋白-CDK复合体共同构成了细胞周期时钟调控机制的核心。每种细胞周期蛋白都与一个或一系列CDK相互结合,D型细胞周期蛋白(D1、D2、D3)结合CDK4或CDK6;E型细胞周期蛋白(E1和E2)结合CDK2;A型细胞周期蛋白(A1和A2)结合CDK2或CDC2;B型细胞周期蛋白(B1和B2)结合CDC2。不同cyclin-CDK复合体在不同细胞周期时间点被激活。
5 细胞周期的调控
像所有精确调控的体系一样,各种cyclin-CDK复合体的激活必须是可以调节的,以强化对细胞周期特定时相的调控。其中最重要的调控手段在于其改变了细胞周期的各个时相中细胞周期蛋白的表达水平和效率。与之相对的是,激活所有的CDK表达水平变化很小。
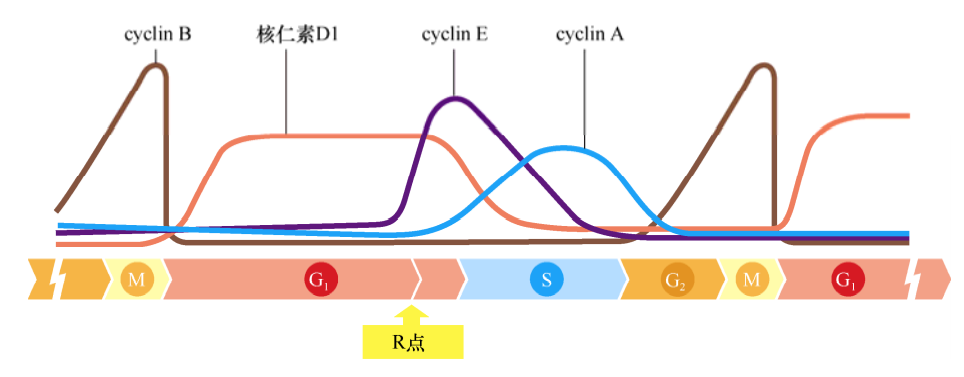
各种细胞周期蛋白随着细胞周期时相的变化而快速地改变,是因为它们能够被快速降解,其降解主要是通过泛素化途径进行的。细胞周期蛋白的快速降解及之后的逐渐累积在细胞周期中具有重要的意义,因为它引导细胞周期时钟只向一个方向发展,就像一个齿轮一样。
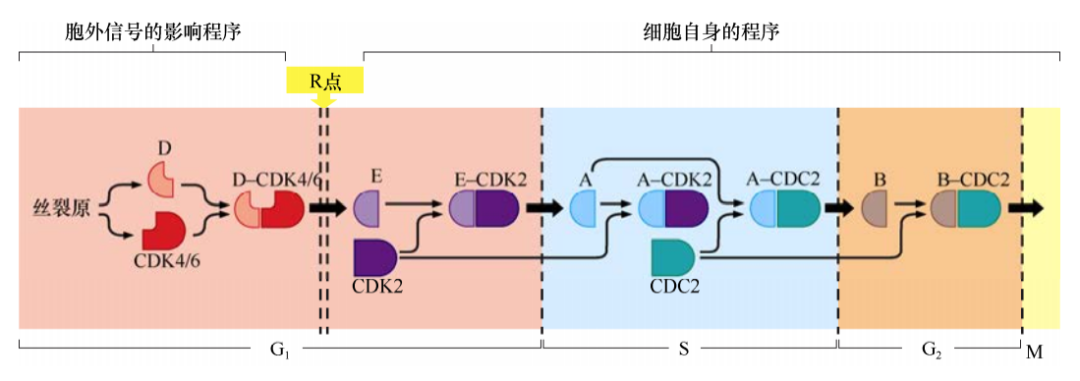
细胞外信号在G1期能够强烈影响D型细胞周期蛋白的表达水平,细胞中其他细胞周期蛋白的水平受细胞内信号的调控并与细胞周期的进程严格一致。因此,细胞通过R点之后,cyclinE-CDK2复合体被激活,其他细胞周期蛋白-CDK复合体的形成也符合一定的程序而不依赖于细胞外的生理信号。细胞周期的这种协调运转部分是由于细胞周期某时相中的细胞周期蛋白-CDK复合体能激活下个时相,并且抑制上个时相的活化而产生的。
clin-CDK复合体在不同细胞周期时间点被激活。
6 癌症中的细胞周期调控
随着1986年发现了Rb基因,同时也发现该基因编码一个约105kDa的磷酸化核蛋白,这个蛋白被称为pRb,在多种肿瘤细胞都发现该蛋白质的缺失或结构缺陷。
已有的试验结果显示,pRb的磷酸化与细胞周期的进程相一致。随着细胞通过M/G1期转化点,pRb上绝大多数磷酸化基团被水解去除,pRb保持非磷酸化状态;当细胞通过G1期后,pRb被加上少量的磷酸化基团,产生低磷酸化pRb;然而,当细胞通过R点后,cyclinE-CDK2大量磷酸化pRb,使pRb保持高度磷酸化状态;在剩下的整个细胞周期中,pRb的磷酸化持续增加,直到细胞进入M期。
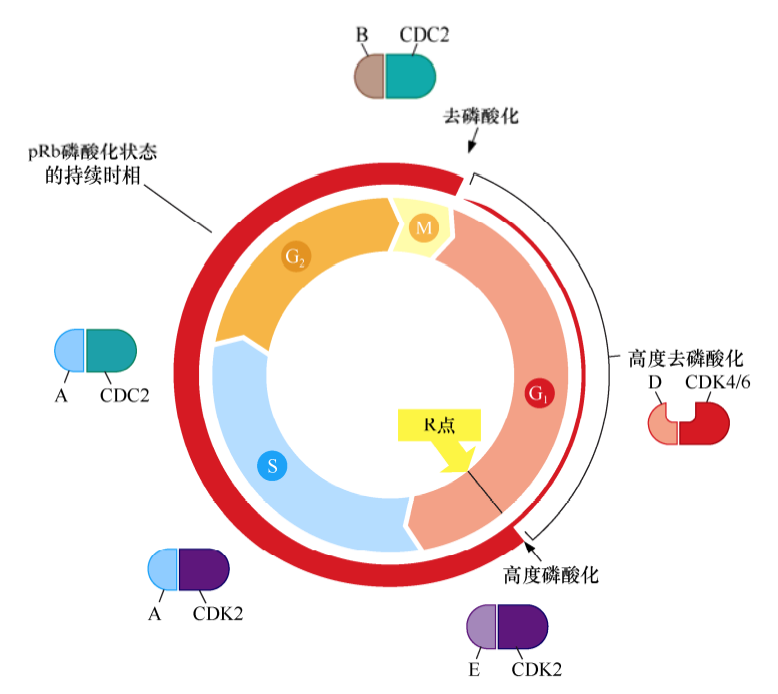
许多证据表明,当细胞通过R点门控后,在G1早期和中期起生长抑制作用的pRb被高度磷酸化而失去活性,继而成为部分或完全无活性的生长抑制因子。实际上,pRb就像这扇大门的守护者一样,使这条通道保持关闭状态,直到pRb被高度磷酸化而失去生长抑制功能,这扇大门才打开,才能允许细胞进入G1晚期及后续的细胞周期时相。
这加深了我们对肿瘤细胞转化过程的理解:在正常细胞中Rb发挥肿瘤抑制基因的功能,因此,Rb基因通过其编码蛋白pRb以某种方式抑制细胞的增殖。肿瘤发生后,所有肿瘤细胞中存在过量激活的有丝分裂信号通路,有丝分裂信号转导通过Ras使pRb先低磷酸化最终高度磷酸化,这种磷酸化作用的启动是通过诱导编码cyclinD基因的表达来实现的,这最终导致pRb的功能失活,进而产生有丝分裂信号释放。
人类癌症细胞生长调控失控的原因中,最直接的就是突变导致的Rb基因失活。此外,在多种人类肿瘤细胞中另一种致使pRb功能失活的策略就是表达极高水平的cyclinD1,这种现象在乳腺癌细胞中十分常见。癌细胞采取的另一种更加曲折的、使pRb机制失活的方式是阻断肿瘤抑制蛋白p16INK4A的表达。缺失p16INK4A蛋白会导致cyclinD-CDK4/6激酶过度活化,从而使pRb磷酸化失去了刹车机制,最终导致pRb磷酸化失调和被灭活。
参考文献:
1. 《The biology of CANCER》second edition. Robert.A Weinberg
作者:小药说药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











谢谢分享
7
#癌症# #CDK# #细胞周期# #检验点#
10