65年前,诺贝尔奖获得者Peter Medawar在他的诺贝尔奖获奖论文《Nature》中首次描述了小鼠移植免疫耐受是可以实现的。 几十年来,免疫学家都把普遍的免疫耐受作为移植医学领域的主要目标。 对于许多终末期器官衰竭的患者来说,器官移植或许是生存下去的唯一希望。为了防止移植排斥,受者必须长期服用免疫抑制剂。虽在短期内可有效预防排斥反应,但长期使用易感染甚至患癌。 如果诱导产生供体特异性免疫耐受,就能克服这个问题,也可以减少免疫抑制剂的使用。
1 世界首例免疫耐受诱导成功
不久前,来自意大利的研究者报道了一例活体肾脏移植受者用自体骨髓间充质干细胞(BMSCs)输注诱导免疫耐受获得成功的案例。在没有使用免疫抑制剂的情况下,可完全耐受新器官18个月。
研究结果在 Stem Cells Translational Medicine 杂志发表,研究论文题目为“ Kidney transplant tolerance associated with remote autologous mesenchymal stromal cell administration” 。
研究人员表示,这是世界首例通过 MSCs 输注受益的器官移植患者,也为 MSCs 成为解决人体器官移植排斥问题的有效方法提供了证据。
事情是这样的:在2010年10月,一位患有终末期肾病的 37 岁男性,接受了活体肾移植,同时参与了一项经体外扩增的自体BMSCs移植前输注的安全性和可行性试验研究。在器官移植前一天,患者进行了自体BMSCs 输注,并在器官移植后的六天内,每天静脉接受低剂量的兔抗人胸腺细胞免疫球蛋白输注治疗。
患者经器官移植前回输BMSCs,之后肾功能迅速恢复,且在移植后 2 年内功能稳定。同时血液检测结果显示,患者对供体肾脏产生了耐受性。患者所服用的免疫抑制剂逐渐减少,直到完全停止服用。截止报道时,患者已经 18 个月没有使用免疫抑制剂,且移植后的肾脏功能正常。
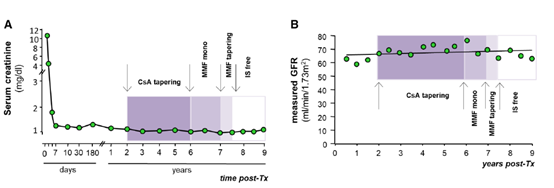
在随后9年的随访中,血清肌酐始终保持在1mg/dL左右(图A)。每6个月测定一次碘海醇的血浆清除率,结果显示肾小球滤过率(GFR)随时间增加的好趋势(图B)。
本病例证明在肾移植中,提前输注BMSCs,可完全停用维持免疫抑制剂,最终达到免疫耐受状态。
研究人员认为,本案例成功真正归因于移植前 MSCs 输注所诱导出持续促耐受性环境。
2 间充质干细胞与免疫调控
间充质干细胞(Mesenchymal stem cells,MSCs),是一种存在于多种组织(如骨髓、脐带组织、胎盘组织、脂肪组织等许多组织中),具有自我复制能力和多向分化潜力的成体干细胞。
20世纪70年代,Friedenstein等成功通过贴壁分离培养的方法,从骨髓中分离出一种成纤维细胞样的细胞,具有分化为成骨细胞的细胞集落(CFU-F),而且支持造血克隆的形成。
1988年,Friedenstein将这类干细胞命名为“骨髓基质/干细胞”(marrow stromal /stem cells)。
1995年,Lazarus等报道MSCs 的第一篇临床研究成果,用于骨髓移植患者治疗的临床研究,观察临床效果并证明这些基质细胞的安全性。
2002 年,Di Nicola M 和 Bartholomew 等人发现MSCs具有强大的免疫抑制能力,具有低免疫原性,很难引起免疫排斥反应。
MSCs的免疫调节特性,非常有利于用于治疗免疫性疾病,包括移植排斥反应和自身免疫性疾病。MSCs可以通过抑制淋巴细胞的增殖、抑制抗原呈递细胞分化成熟及功能发挥、抑制CTL形成、增加调节性T细胞比例等多种途径发挥免疫调节作用。
在再生医学领域,一直被寄予厚望却迟迟难以取得进展的MSCs,逐渐成为抵抗免疫排斥、诱导免疫耐受、长期维持移植器官的理想细胞,并取得许多令人兴奋的结果。
间充质干细胞在同种免疫反应中的免疫调节作用(来源:Nature)
3 文末小结
当患者进行器官移植后,外来器官作为一种“异己成分”被受者免疫系统识别,后者发起针对移植物的攻击、破坏和清除,这种免疫学反应叫做移植排斥反应(transplant rejection)。
为了解决移植排异问题,必须服用免疫抑制剂,以降低移植排斥反应。这些免疫抑制剂有严重的副作用,使患者更容易感染和发生癌症。因此,如果诱导产生供体特异性免疫耐受就能克服这个问题。
器官移植前输注MSCs,就是新的方法之一。动物实验证实,移植前,进行MSCs输注,似乎可以通过一种“教育”的方式来抑制受体对供体器官的免疫排斥。
对于意大利肾脏移植患者的成功,英国纽卡斯尔大学 Emily Thompson 表示,如果真的是MSCs在起作用,“那将是一件大事”。伦敦盖伊和圣托马斯医院的 Chris Callaghan 也表示,“虽然现在还处于非常早期的阶段,但一旦成功,将彻底改变(器官移植)游戏规则。”
相信通过进一步的努力,MSCs在临床器官移植方面将得到更广泛的应用。
参考文献: [1]https://stemcellsjournals.onlinelibrary.wiley.com/doi/full/10.1002/sctm.19-0185
作者:小明月
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#移植免疫#
82
#间充质干细#
60
#活体肾移植#
70
#世界首例#
91
#抑制剂#
72