Nature子刊:中山大学宋尔卫/罗曼莉发现乳腺癌芳香化酶抑制剂耐药的潜在新机理
2022-11-27 iNature iNature
该研究表明芳香酶抑制剂(AI)耐药乳腺肿瘤表现出增强的有氧糖酵解特征,长非编码RNA(lncRNA)DIO3OS上调,这与AI治疗乳腺癌患者的预后不良相关。
芳香化酶抑制是一种有效的内分泌疗法,可阻断绝经后雌激素受体 (ER) 阳性乳腺癌患者的异位雌激素产生,但许多患者会产生耐药性。
2022年11月22日,中山大学宋尔卫及罗曼莉共同通讯在Nature Communications 发表题为“Long noncoding RNA DIO3OS induces glycolytic-dominant metabolic reprogramming to promote aromatase inhibitor resistance in breast cancer”的研究论文,该研究表明芳香酶抑制剂(AI)耐药乳腺肿瘤表现出增强的有氧糖酵解特征,长非编码RNA(lncRNA)DIO3OS上调,这与AI治疗乳腺癌患者的预后不良相关。长期雌激素剥夺诱导ER阳性乳腺肿瘤细胞中DIO3OS表达,进一步增强有氧糖酵解,促进体外和体内雌激素非依赖性细胞增殖。
在机制上,DIO3OS与聚嘧啶束结合蛋白1(PTBP1)相互作用,通过保护其3'UTR的完整性来稳定乳酸脱氢酶A(LDHA)的mRNA,随后上调LDHA表达并激活AI耐药乳腺癌细胞中的糖酵解代谢。研究结果强调了lncRNA在调节糖酵解代谢关键酶以响应内分泌治疗中的作用,以及靶向DIO3OS逆转ER阳性乳腺癌AI耐药性的潜力。

有氧糖酵解,也称为Warburg效应,是癌症能量代谢重塑最显着的特征。肿瘤细胞更喜欢糖酵解途径而不是氧化磷酸化,氧化磷酸化主要将葡萄糖转化为乳酸。此外,糖酵解代谢产物为生物合成提供了必要的材料,赋予肿瘤细胞生长优势。具体来说,乳酸脱氢酶A(LDHA)负责将丙酮酸转化为乳酸,乳酸已被证明通过调节血管生成,转移,治疗耐药性以及慢性炎症和免疫逃逸来促进肿瘤进展。糖酵解抑制剂与放疗或化疗联合使用可使肿瘤细胞对治疗诱导的细胞凋亡敏感,表明靶向异常糖代谢可能为逆转癌症的治疗耐药性提供新的策略。
约三分之二的乳腺癌表达雌激素受体-α(ERα,以下简称ER),需要内分泌治疗来抑制雌激素信号传导依赖性肿瘤生长。芳香化酶抑制剂(AI)可以使芳香化酶失活,芳香化酶是一种将雄激素转化为雌激素的限制性酶,从而降低雌激素水平并抑制ER阳性乳腺癌细胞增殖。在绝经后患者中,第三代AI药物(来曲唑、阿那曲唑和依西美坦)已成为ER阳性乳腺肿瘤的一线辅助治疗,其治疗效果优于曾经是乳腺癌经典内分泌药物他莫昔芬。
然而,对芳香酶抑制的获得性耐药性是辅助内分泌治疗失败的主要原因,因此破译ER阳性乳腺癌AI耐药的分子机制至关重要且紧迫。在目前的研究中,大多数发现集中在ER和其他生长因子受体信号传导的失调上,而代谢重编程是恶性肿瘤的关键标志之一,在获得AI耐药性时很少讨论。
长链非编码RNA(LncRNA)是长度超过200个核苷酸的转录本,缺乏蛋白质编码能力。迄今为止,许多研究已经揭示了lncRNA作为在转录,转录后和表观遗传水平上调节基因表达的关键分子,从而影响肿瘤发展的多个步骤。据报道,它可以调节癌细胞中的有氧糖酵解。此前研究已经证明外泌体lncRNA HISLA可以增强有氧糖酵解并诱导乳腺癌细胞的化学耐药性。
尽管如此,lncRNA在AI耐药ER阳性乳腺癌糖酵解改变中的作用及其机制需要进一步阐明。在这项工作中,比较了AI治疗ER阳性乳腺癌患者临床样本中的lncRNA表达谱,并确定DIO3OS是重编程AI耐药乳腺肿瘤葡萄糖代谢的重要RNA调节因子。
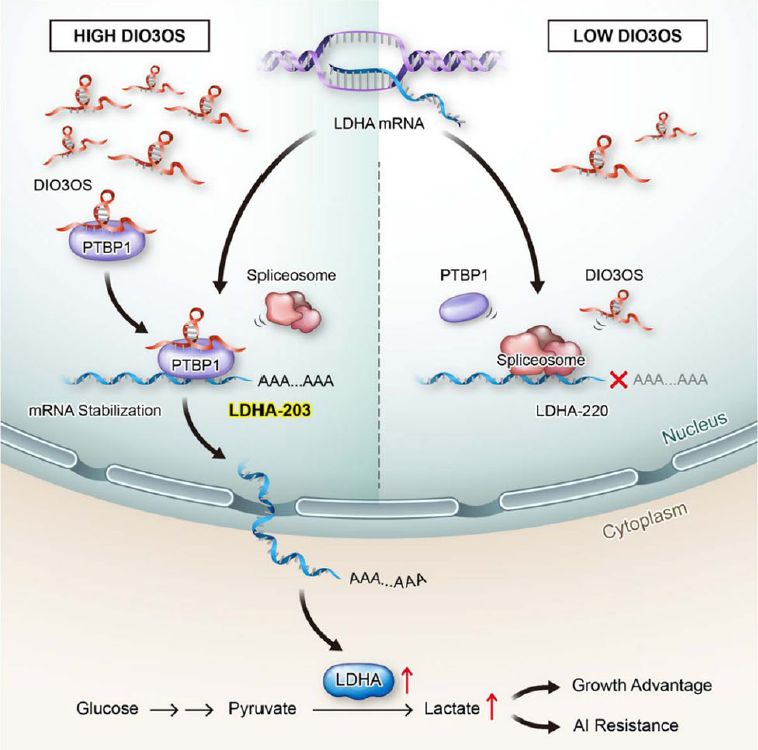
文章模式图(图源自Nature Communications )
靶向癌症代谢成为改善抗癌治疗的重要策略。随着DIO3OS在经历AI耐药的乳腺癌细胞中的表达增加,DIO3OS / PTBP1 / LDHA糖酵解级联反应的异常激活可能赋予肿瘤细胞代谢适应,使它们能够从AI引起的雌激素缺乏中存活下来。未来的转化研究将侧重于探索特定DIO3OS敲低的有效方法,以使乳腺癌细胞对AI治疗重新敏感。
参考消息:
https://doi.org/10.1038/s41467-022-34702-x
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言