【论著】| LncRNA PKD2-2-3对肺腺癌细胞增殖、克隆形成、迁移及侵袭能力的影响
2023-09-17 中国癌症杂志 中国癌症杂志
本研究旨在探讨lncRNA PKD2-2-3在肺腺癌细胞和组织中的表达情况以及lncRNA PKD2-2-3表达变化对肺腺癌细胞恶性生物学行为和EMT的影响。
[摘要] 背景与目的:长链非编码RNA(long non-coding RNA,lncRNA)在肺腺癌患者中异常表达,与肿瘤的发生、发展和化疗耐药密切相关。本研究旨在探讨lncRNA蛋白激酶D2(lncRNA PKD2-2-3)在肺腺癌发生、发展过程中发挥的生物学功能,验证lncRNA PKD2-2-3对肺腺癌细胞增殖、克隆形成、迁移和侵袭的影响。方法:基于Affymetrix人类基因芯片转录组阵列2(Affymetrix® GeneChip Human Transcriptome Array 2.0,HTA2.0)分析3对肺腺癌组织及癌旁组织,寻找在肺腺癌组织中高表达的lncRNA,其中lncRNA PKD2-2-3的表达差异最大。利用基因表达综合数据库(Gene Expression Omnibus,GEO)中GSE19188和GSE30219的数据分析lncRNA PKD2-2-3在肺腺癌组织中的表达和对患者预后的影响。通过实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测lncRNA PKD2-2-3在细胞系(HBE、A549、PC9)中的表达情况。在A549和PC9两种细胞系中使用siRNA干扰技术敲低lncRNA PKD2-2-3的表达,通过细胞计数试剂盒-8(cell counting kit-8,CCK-8)实验和克隆形成实验检测lncRNA PKD2-2-3表达对肺腺癌细胞增殖和克隆形成能力的影响;划痕实验和transwell实验分别检测lncRNA PKD2-2-3表达对肺腺癌细胞迁移和侵袭的影响。蛋白质印迹法(Western blot)检测敲低lncRNA PKD2-2-3表达后对上皮-间质转化(epithelial-mesenchymal transition,EMT)相关蛋白E-钙黏蛋白(E-cadherin)和N-钙黏蛋白(N-cadherin)表达水平的影响。皮下移植瘤模型探究lncRNA PKD2-2-3在体内对肺腺癌细胞增殖的影响。结果:LncRNA PKD2-2-3在肺腺癌组织中呈高表达,且高表达的患者预后较差。对比正常气管上皮永生化细胞HBE,lncRNA PKD2-2-3在肺腺癌细胞系A549和PC9中高表达,敲低lncRNA PKD2-2-3的表达抑制肺腺癌细胞的增殖、克隆形成、迁移和侵袭能力。Western blot结果显示,敲低lncRNA PKD2-2-3后,E-cadherin表达水平升高,N-cadherin表达水平降低。皮下移植瘤实验表明,在体内lncRNA PKD2-2-3敲低后抑制肺腺癌的生长。结论:lncRNA PKD2-2-3在肺腺癌组织中上调表达,且与患者的不良预后相关,lncRNA PKD2-2-3的高表达促进肺腺癌细胞的增殖、克隆形成、迁移和侵袭能力,体内外实验表明lncRNA PKD2-2-3的表达与肺腺癌的EMT过程密切相关。
[关键词]肺腺癌;lncRNA PKD2-2-3;细胞迁移;细胞侵袭;上皮间质转化
[Abstract] Background and purpose: Long non-coding RNA (lncRNA) is abnormally expressed in lung adenocarcinoma patients, and closely related to tumor occurrence, development and chemotherapy resistance. In this study, we mainly investigated the biological function of lncRNA PKD2-2-3 and verified its effect on the proliferation, colony formation, migration and invasion in lung adenocarcinoma. Methods: Three pairs of lung adenocarcinoma tissues and adjacent tissues were analyzed based on expression profiling Affymetrix® GeneChip Human Transcriptome Array 2.0 (HTA2.0), and we focused on lncRNA PKD2-2-3 that showed most significant difference between lung adenocarcinoma issues and adjacent tissues. Besides, we found the upregulated expression of lncRNA PKD2-2-3 in lung adenocarcinoma tissues and suggested the relation of lncRNA PKD2-2-3 expression with prognosis by using GSE19188 and GSE30219 data in Gene Expression Omnibus (GEO) database. Real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) was used to detect the expression of lncRNA PKD2-2-3 in cell lines including HBE, A549 and PC9. After using siRNAs to decrease the expression of lncRNA PKD2-2-3 in A549 and PC9, we detected cell proliferation and colony formation by cell counting kit-8 (CCK-8) assay and colony formation assay. Effects of lncRNA PKD2-2-3 on migration and invasion in lung adenocarcinoma cells were detected by wound-healing assay and transwell assay, respectively. Moreover, we detected expression levels of E-cadherin and N-cadherin that were epithelial-mesenchymal transition (EMT) related genes by Western blot. The effect of lncRNA PKD2-2-3 on the formation and growth of lung adenocarcinoma in vivo was verified by subcutaneous transplantation tumor model. Results: LncRNA PKD2-2-3 was highly expressed in lung adenocarcinoma tissue, and was positively associated with poor prognosis of lung adenocarcinoma patients. Compared with human bronchial epithelial cells (HBE), lncRNA PKD2-2-3 was overexpressed in A549 and PC9. The proliferation, colony formation, migration and invasion of lung adenocarcinoma cells were significantly inhibited when decreasing the expression level of lncRNA PKD2-2-3. Western blot also showed that the expression level of E-cadherin was increased, while the level of N-cadherin was decreased after lncRNA PKD2-2-3 knockdown. Subcutaneous tumor transplantation experiments showed that lncRNA PKD2-2-3 knockdown inhibited the growth of lung adenocarcinoma in vivo. Conclusion: LncRNA PKD2-2-3 expression was upregulated in lung adenocarcinoma tissues, and it was associated with poor prognosis of lung adenocarcinoma patients. Overexpression of lncRNA PKD2-2-3 promoted the proliferation, colony formation, migration and invasion of lung adenocarcinoma cells. LncRNA PKD2-2-3 level was closely related to EMT process in lung adenocarcinoma in vitro and in vivo.
[Key words] Lung adenocarcinoma; LncRNA PKD2-2-3; Cell migration; Cell invasion; Epithelial-mesenchymal transition
肺癌是起源于人体肺部支气管黏膜或腺体的恶性肿瘤,分为小细胞肺癌和非小细胞肺癌,非小细胞肺癌主要分为肺腺癌、肺鳞癌、大细胞肺癌等。最新的美国癌症协会年度报告显示肺癌的发病率居于第二,致死率高居第一[1],在中国肺癌同样有高发生率和致死率[2]。大多数肺腺癌患者由于缺乏临床表现而错过了最佳治疗时机,确诊时已处于晚期,5年生存率低于15%[1]。因此,针对肺腺癌的发生、发展进行分子特征研究,寻找潜在的诊断和治疗靶点,具有重要的临床意义。
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度超过200个核苷酸,不编码或极少部分编码短肽的核酸片段[3]。目前已有一些文献显示lncRNA在肺腺癌患者中异常表达,与肿瘤的发生、发展和化疗耐药密切相关。LncRNA CAR10可以通过miR-203/30/SNAI轴调控肺腺癌上皮-间质转化(epithelial-mesenchymal transition,EMT),促进肺腺癌转移[4]。LncRNA MARCKSL1-2在紫杉醇耐药的肺腺癌细胞中低表达,通过促进miR-200b的表达和抑制组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)的表达增强肺腺癌细胞的紫杉醇化疗敏感性[5]。
LncRNA通过影响肿瘤的凋亡和EMT等调控肿瘤的增殖和转移,lncRNA及其调控通路的关键分子可望成为肿瘤防止的新靶点。本研究利用3例肺腺癌患者的肿瘤组织和对照肺组织进行转录组芯片分析,筛选出在肺腺癌组织中显著高表达的lncRNA蛋白激酶D2(lncRNA PKD2-2-3)。已有研究[6]发现,lncRNA PKD2-2-3/miR-328/GPAM作用网络调控胆管癌增殖、侵袭和对5-氟尿嘧啶的药物抵抗,lncRNA PKD2-2-3可增加CD44阳性、CD133阳性细胞比例,可以作为肿瘤干细胞的分子标志物[7]。LncRNA PKD2-2-3在肺腺癌中的研究目前鲜见报道。
本研究旨在探讨lncRNA PKD2-2-3在肺腺癌细胞和组织中的表达情况以及lncRNA PKD2-2-3表达变化对肺腺癌细胞恶性生物学行为和EMT的影响。
1 材料和方法
1.1 细胞、试剂和仪器
人正常支气管上皮细胞系HBE和肺腺癌细胞系A549、PC9由中南大学肿瘤研究所李征副教授课题组赠与,所有细胞培养于含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基中,放置于37 ℃、CO2体积分数为5%的培养箱中培养。RPMI-1640培养基购自大连美伦生物科技技术有限公司,FBS购自美国Gibco公司,RNA提取试剂盒购自天根生化科技(北京)有限公司,反转录试剂盒、实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂、细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自南京诺维赞生物科技股份有限公司, LipofectamineTM3000转染试剂购自美国赛默飞公司,transwell小室购自美国Corning公司,结晶紫购自中国北京索莱宝科技有限公司,放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液购自上海碧云天生物技术有限公司,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和所有引物购自生工生物工程(上海)股份有限公司,小干扰RNA(small interfering RNA,siRNA)购自广州市锐博生物科技有限公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司,二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自美国Thermo Fisher Scientific公司,E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)和β-actin抗体购自美国Cell Signaling Technology公司,化学发光仪购自美国BioRad公司,雌性非肥胖糖尿病-重症联合免疫缺陷(non-obese diabetic-severe combined immunodeficiency,NOD-SCID)小鼠购自北京维通利华实验动物技术有限公司。
1.2 细胞转染和分组设置
取对数期生长的A549和PC9细胞铺入6孔板中,过夜培养后分为6组:A549对照组(si-CTR组)、A549敲低组1(si-lncRNA PKD2-2-3_001组)、A549敲低组2(si-lncRNA PKD2-2-3_002组)、PC9对照组(si-CTR组)、PC9敲低组1(si-lncRNA PKD2-2-3_001组)、PC9敲低组2(si-lncRNA PKD2-2-3_002组)。将siRNA按以上分组与LipofectamineTM3000混合转染进细胞。Si-RNA序列:si-lncRNA PKD2-2-3_001为5‘-AAGCAAAUCACUGCAAUUCUC-3‘,si-lncRNA PKD2-2-3_002为5‘-UUUUCCUCA GAACUUCCAGAA-3‘。NOD-SCID小鼠移植瘤实验使用shRNA序列与si-lncRNA PKD2-2-3_002相同。
1.3 RNA提取
采用TRIzol试剂提取RNA,采用分光光度计测定RNA的浓度和纯度,接着反转录试剂盒将RNA反转录为cDNA,不同组别计算同一投入量,使用特异性引物在RTFQ-PCR仪上扩增,最后使用2-ΔΔCt方法计算,以U1作为内对照对实验结果进行标准化。LncRNA PKD2-2-3正向引物序列为5‘-TGTGCCATACCATTAAACAGG-3‘,lncRNA PKD2-2-3反向引物序列为5‘-GCCTCT GATTGAAAATGAGAAC-3‘。U1正向引物序列为5‘-GAAACTCGACTGCATAATTTGTGGTAG-3‘,U1反向引物序列为5‘-CTTGGCGTACAGTCT GTTTTTGAAACTC-3‘。实验重复3次。
1.4 细胞增殖和克隆形成
使用CCK-8试剂盒检测A549和PC9各组细胞的增殖情况。6组细胞转染48 h后,从6孔板中消化下来所有细胞,计数800个置于96孔板中,分别在0、1、2、3、4和5 d时加入20 μL的CCK-8试剂(5 mg/mL),置于37 ℃温育2 h,使用多孔分光光度计在450 nm波长下检测所有样本,记录吸光度(D)值。计数1 000个细胞种植在6孔板中,放置在37 ℃培养箱中生长2周,磷酸缓冲盐溶液(phosphate-buffered saline,PBS)轻柔清洗冲洗,后续固定、染色、拍照、计数等方法详见参考文献[4,8]。实验重复3次。
1.5 细胞侵袭
Matrigel基质胶预涂到24孔transwell小室,37 ℃放置3 h。胰酶消化下所有组的细胞,用无血清RPMI-1640培养基稀释并重悬为20 000个细胞/小室,细胞加入上室,同时将600 μL含20%FBS清的培养液加入下室,培养24 h。后续固定、染色、拍照、计数等方法详见参考文献[4,8]。实验重复3次。
1.6 细胞迁移
A549和PC9细胞迁移能力可通过划痕愈合实验评估。将各组细胞接种到6孔板中,使用10 μL无菌无酶移液器吸嘴在细胞中划痕。D-Hanks清洗漂浮细胞后,分别在0、24和48 h对各组细胞拍照。实验重复3次。
1.7 蛋白质印迹法(Western blot)检测细胞信号转导通路相关蛋白的水平
细胞转染48 h后,使用RIPA裂解液裂解细胞,并预冷离心机,4 ℃条件下12 000 r/min离心30 min收集上清液。BCA法测定蛋白浓度,将60 ng变性好的蛋白加入梳孔内,进行SDS-PAGE,转膜到PVDF膜上,5%脱脂奶粉封闭1 h,4 ℃过夜温育一抗(E-cadherin 1∶1 000、N-cadherin 1∶1 000、β-actin 1∶5 000),室温下用吐温-20磷酸缓冲盐溶液(phosphate-buffered saline with Tween-20,PBST)清洗3次,37 ℃温育二抗1 h,通过化学发光仪曝光信号并拍照。
1.8 皮下移植瘤实验
小鼠实验通过上海市第一人民医院实验动物福利伦理审查(2019-A012-01)。选用6周龄雌性NOD-SCID小鼠构建皮下移植瘤模型。18只小鼠随机分为两组,每组9只。收集对照组(sh-CTR)和敲低组(sh-lncRNA PKD2-2-3)细胞,用PBS重悬为2.5×107个细胞/mL的悬液,200 μL注射入小鼠右背部皮下,观察并记录移植瘤的生长情况。28 d结束后,采用CO2窒息的方式处死小鼠,取出瘤块并拍照。
1.9 临床信息与数据库
本研究主要涉及3个数据库,分别是GSE121397、GSE19188、GSE30219。GSE121397为中南大学李征课题组所上传数据,包括3位肺腺癌转移患者的癌旁组织与癌组织基因表达谱数据,详细信息请见参考文献[4]。GSE19188数据集为早期非小细胞肺癌基因表达谱数据,其中包含45例肺腺癌组织和65例正常组织数据,详细信息请见参考文献[9]。GSE30219数据集包含85例肺腺癌组织和14例正常组织数据,详细信息请见参考文献[10]。
1.10 统计学处理
使用GraphPad Prism 8.0软件对所有数据进行统计,数据描述以x±s表示。组间比较采用t检验、单因素方差分析。按照Kaplan-Meier分析法进行生存分析,并获得半数生存期、统计学参数等数据。P<0.05为差异有统计学意义。
2 结 果
2.1 LncRNA PKD2-2-3在肺腺癌中的表达情况及其与患者预后的关系
前期,我们利用3例肺腺癌患者配对癌组织和癌旁组织进行了Affymetrix人类基因芯片转录组阵列2(Affymetrix® Gene Chip Human Transcriptome Array 2.0,HTA2.0)表达谱芯片检测,数据集为GSE121397[4],构建了不同差异表达的lncRNA表达谱(图1A)。随后我们对癌与癌旁组织中上调或下调差异表达最大的10个lncRNA进行热图分析,其中上调表达差异最大的是n336928,即lncRNA PKD2-2-3(图1B)。为探究lncRNA PKD2-2-3表达与肺腺癌患者预后的关系,我们从基因表达综合数据库(Gene Expression Omnibus,GEO)中下载并分析了两个组织芯片数据集GSE19188和GSE30219。在GSE19188中,对比癌旁组织(-2.35±0.20),lncRNA PKD2-2-3在肺腺癌组织中的表达(1.70±0.24)显著上调(P<0.001),在GSE30219数据集中分析lncRNA PKD2-2-3表达也得到了相同的结果,癌旁组织和癌组织相对表达量分别为7.30±0.43和11.03±0.16(P<0.001,图1C)。
在数据集GSE19188中,低表达lncRNA PKD2-2-3患者的中位生存期较长,基于现有数据未能计算出,高表达lncRNA PKD2-2-3患者的中位生存期为21.47个月。在数据集GSE30219中,对比低表达lncRNA PKD2-2-3患者(193个月),高表达lncRNA PKD2-2-3患者的中位生存期显著降低 (89个月),以上结果表明与低表达lncRNA PKD2-2-3患者相比,高表达lncRNA PKD2-2-3患者预后更差(P<0.05,图1D)。利用RTFQ-PCR检测HBE、A549、PC9共3种细胞系lncRNA PKD2-2-3表达水平,与HBE细胞(1.00±0.06)相比,lncRNA PKD2-2-3相对表达水平在A549(67.67±5.18)和PC9细胞(184.30±20.22)中显著升高(P<0.001,图2A)。
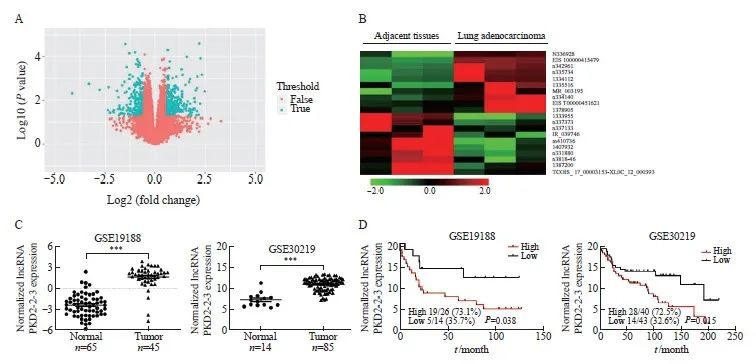
图1 LncRNA PKD2-2-3在肺腺癌中表达显著上调,且与患者预后密切相关
Fig. 1 lncRNA PKD2-2-3 was upregulated in lung adenocarcinoma tissues and associated with poor prognosis
A: Volcano plots revealed differentially expressed lncRNAs between lung adenocarcinoma tissues and matched non-tumor lung tissues. Cutoff criteria were an absolute fold change of >1.5 or <-1.5 and P<0.05. Red color points represented the lncRNA that could meet filter criteria, while blue color points represented the lncRNA that could not meet filter criteria. B: Top 10 upregulated and downregulated differentially expressed lncRNAs between tumor tissues and normal tissues. n336928, namely lncRNA PKD2-2-3, was the most differentially expressed lncRNA. C: The expression of lncRNA PKD2-2-3 between tumor tissues and normal tissues in GSE19188 and GSE30219. ***: P<0.001, compared with each other. D: The analysis of lncRNA PKD2-2-3 expression level with prognosis of patients with lung adenocarcinoma in GSE19188 and GSE30219. The GSE19188 dataset contained the survival information of 40 patients with lung adenocarcinoma. There were 26 patients in lncRNA PKD2-2-3 high expression group, including 19 deaths. The GSE30219 dataset contained the survival information of 83 patients with lung adenocarcinoma. There were 40 patients in lncRNA PKD2-2-3 high expression group, including 29 deaths.
2.2 敲低LncRNA PKD2-2-3抑制肺腺癌细胞的增殖和克隆形成
采用siRNA敲低肺腺癌细胞lncRNA PKD2-2-3表达后,经RTFQ-PCR分析,实验结果显示,与A549对照组(1.00±0.08)和PC9对照组(1.00±0.04)相比,si-lncRNA PKD2-2-3_001 A549组(0.50±0.15)、si-lncRNA PKD2-2-3_002 A549组(0.40±0.12)、si-lncRNA PKD2-2-3_001 PC9组(0.46±0.06)和si-lncRNA PKD2-2-3_002 PC9组(0.42±0.03)中lncRNA PKD2-2-3的表达水平明显降低,差异有统计学意义(P <0.05,P<0.01,P<0.001,图2A)。
在A549和PC9细胞中使用si-lncRNA PKD2-2-3敲低lncRNA PKD2-2-3表达检测细胞增殖和克隆形成能力,CCK-8实验结果显示,对比对照组A549和PC9,4组敲低组细胞从第3天开始增殖能力明显降低,差异有统计学意义(P<0.05、P <0.01和P<0.001,图2B)。克隆形成实验结果显示,与A549对照组(1.00±0.08)和PC9对照组(1.00±0.02)相比,si-lncRNA PKD2-2-3_001 A549组(0.50±0.04)、si-lncRNA PKD2-2-3_002 A549组(0.50±0.01)、si-lncRNA PKD2-2-3_001 PC9组(0.43±0.05)和si-lncRNA PKD2-2-3_002 PC9组(0.34±0.02)中细胞克隆形成能力显著降低,差异有统计学意义(P <0.05、P<0.01和P<0.001,图2C)。以上结果说明,敲低lncRNA PKD2-2-3水平抑制肺腺癌细胞增殖和克隆形成能力。
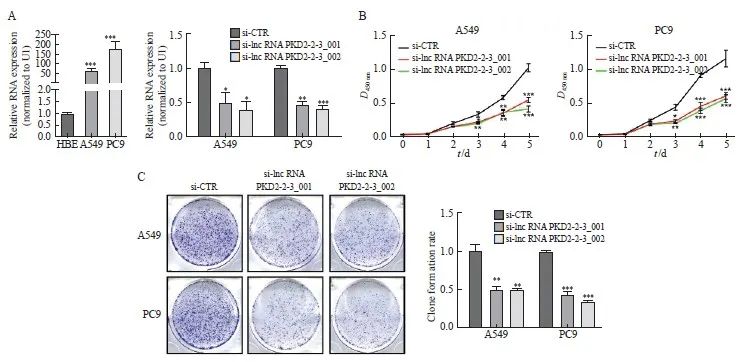
图2 敲低lncRNA PKD2-2-3表达抑制肺腺癌细胞增殖和克隆形成能力
Fig. 2 Silencing of lncRNA PKD2-2-3 decreased the proliferation and colony formation of lung adenocarcinoma cell lines
A: The expression level of lncRNA PKD2-2-3 in HBE, A549, and PC9. The expression of lncRNA PKD2-2-3 after two siRNAs transfected into A549 and PC9. B-C: The effect of knocking down lncRNA PKD2-2-3 on lung adenocarcinoma cell proliferation and colony formation.
2.3 敲低LncRNA PKD2-2-3抑制肺腺癌细胞迁移和侵袭
在A549和PC9细胞中使用si-lncRNA PKD2-2-3敲低lncRNA PKD2-2-3表达,利用划痕和transwell实验检测细胞迁移和侵袭能力。划痕实验结果显示,迁移24 h时,与A549对照组(0.54±0.01)和PC9对照组(0.63±0.02)相比,si-lncRNA PKD2-2-3_001 A549组(0.75±0.01)、si-lncRNA PKD2-2-3_002 A549组(0.78±0.03)、si-lncRNA PKD2-2-3_001 PC9组(0.77±0.03)和si-lncRNA PKD2-2-3_002 PC9组(0.92±0.08)中细胞划痕间距增加,迁移能力降低,差异有统计学意义(P <0.05和P<0.001)。迁移48 h时,与A549对照组(0.24±0.01)和PC9对照组(0.34±0.01)相比,si-lncRNA PKD2-2-3_001 A549组(0.53±0.01)、si-lncRNA PKD2-2-3_002 A549组(0.62±0.05)、si-lncRNA PKD2-2-3_001 PC9组(0.61±0.05)和si-lncRNA PKD2-2-3_002 PC9组(0.77±0.01)中细胞划痕间距增加,迁移能力降低,差异有统计学意义(P<0.01和P <0.001,图3A)。
Transwell实验结果表明,与A549对照组(1.00±0.07)和PC9对照组(1.00±0.10)相比,si-lncRNA PKD2-2-3_001 A549组(0.24±0.03)、si-lncRNA PKD2-2-3_002 A549组(0.06±0.02)、si-lncRNA PKD2-2-3_001 PC9组(0.25±0.04)和si-lncRNA PKD2-2-3_002 PC9组(0.07±0.01)中侵袭细胞数明显降低。差异有统计学意义(P<0.01,P<0.001,图3B)。以上实验表明敲低lncRNA PKD2-2-3表达可以抑制肺腺癌细胞A549和PC9的迁移和侵袭能力。
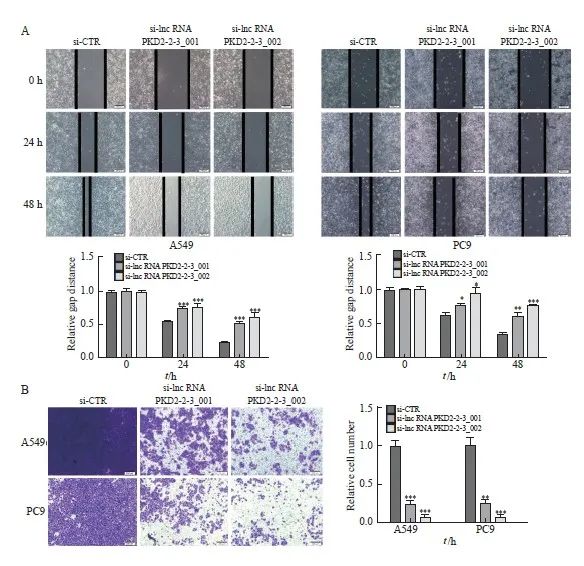
图3 敲低lncRNA PKD2-2-3表达抑制肺腺癌细胞迁移和侵袭
Fig. 3 Downregulated lncRNA PKD2-2-3 inhibited cell migration and invasion of lung adenocarcinoma cell lines
A: The migration was measured at different time points (0, 24, and 48 h) after silencing LncRNA PKD2-2-3. B: LncRNA PKD2-2-3 knockdown decreased the number of invasive cells in A549 and PC9. *: P<0.05, compared with si-CTR; **: P<0.01, compared with si-CTR; ***: P<0.001, compared with si-CTR.
2.4 敲低lncRNA PKD2-2-3抑制皮下移植瘤的生长
为检测lncRNA PKD2-2-3表达对体内细胞增殖能力的影响,选用6周龄雌性NOD-SCID小鼠构建皮下移植瘤模型。18只小鼠随机分为两组,每组9只。收集对照组(sh-CTR)和敲低组(sh-lncRNA PKD2-2-3)细胞,用PBS重悬为2.5×107个 细胞/mL的悬液,200 μL注射入小鼠右背部皮下,每隔3天观察并记录移植瘤的生长情况。实验过程中两组小鼠状态无明显差异,无死亡现 象。
移植瘤模型显示,对比对照组(243.40±18.54),lncRNA PKD2-2-3敲低组皮下移植瘤(140.70±18.73)体积减少(P <0.01,图4B)。第28天测量结束后,以CO2窒息的方式处死小鼠,取出瘤块并拍照(图4C)。以上结果表明降低lncRNA PKD2-2-3表达抑制皮下瘤生长。
2.5 敲低lncRNA PKD2-2-3抑制肺腺癌细胞的EMT
在A549和PC9细胞中敲低lncRNA PKD2-2-3表达后,检测E-cadherin和N-cadherin蛋白的表达水平。Western blot检测结果显示,敲低lncRNAPKD2-2-3后,PC9和A549细胞E-cadherin蛋白相对表达水平较对照组(1.00±0.06)明显增加,分别为3.15±0.05和1.48±0.10,而N-cadherin蛋白的表达水平较对照组(1.00±0.03)显著减少,分别为0.51±0.08和0.65±0.07(图4A)。同样,免疫组织化学检测发现,敲低lncRNA PKD2-2-3的表达,皮下瘤组织中E-cadherin蛋白的表达水平增高,而N-cadherin蛋白的表达水平减少(图4D)。
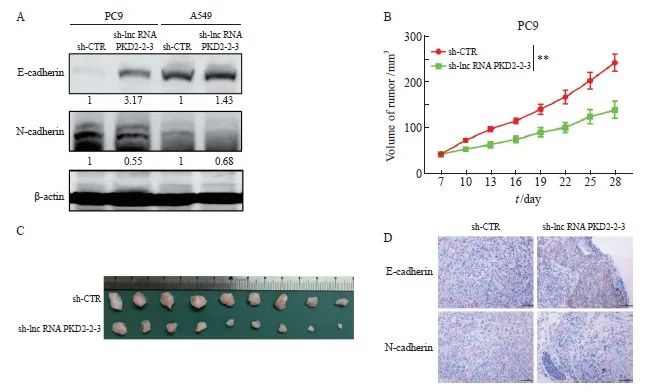
图4 LncRNA PKD2-2-3表达影响EMT进程及在体内影响细胞增殖
Fig. 4 Effect of silencing of lncRNA PKD2-2-3 expression on EMT and cell proliferation in vivo
A: The protein expression level of E-cadherin and N-cadherin were detected by Western blot after knocking down lncRNA PKD2-2-3. B: The tumor growth were monitored after stably-silenced lncRNA PKD2-2-3 (sh-lncRNA PKD2-2-3) PC9 cells were injected the back of NOD-SCID mice. C: Tumor tissues were harvested after 28 days. D: The protein expression of E-cadherin and N-cadherin using immunohistochemistry in control group and sh-lncRNA PKD2-2-3 group.
3 讨 论
肺腺癌是全世界范围内的健康难题,虽然现有的手术、化疗、靶向治疗、免疫治疗等针对肺腺癌治疗的研究取得了显著进展,但是多数患者的病情仍会不断进展,癌细胞可转移至脑、骨等部位,患者5年生存率低,因此寻找有效的肺腺癌诊断标志物和治疗靶点对临床治疗至关重要。
已有研究[11-14]发现,lncRNA参与多种肿瘤的发展进程。在本研究中,我们发现lncRNA PKD2-2-3在肺腺癌组织和肺腺癌细胞系中呈高表达,且高表达lncRNA PKD2-2-3的肺腺癌患者预后较差,说明lncRNA PKD2-2-3具有促进肺腺癌发生、发展的能力。研究[6]显示,lncRNA PKD2-2-3在胆管癌中呈高表达,能促进胆管癌细胞的转移,同时可以增强癌细胞对5-氟尿嘧啶的药物抵抗,从而导致胆管癌的化疗耐药[7]。
本研究发现,lncRNA PKD2-2-3促进肺腺癌细胞的增殖、克隆形成、侵袭和迁移的能力,同时还发现lncRNA PKD2-2-3可以促进肺腺癌细胞的EMT。已有研究[8,15-16]表明,EMT在肺腺癌侵袭转移过程中发挥重要作用。本研究结果显示,在肺腺癌细胞中敲低lncRNA PKD2-2-3的表达可以上调E-cadherin蛋白表达和下调N-cadherin蛋白的表达,lncRNA PKD2-2-3可以促进肺腺癌细胞的EMT进程,进而可能影响到肺腺癌患者的肿瘤转移与预后。但是,在本研究中并未进一步探究出lncRNA PKD2-2-3调控肺腺癌EMT的具体机制,以及lncRNA PKD2-2-3可能在肺腺癌患者肿瘤转移过程中的影响,详细的调控机制还有待于后期的进一步验证。
综上,本研究初步探讨了lncRNA PKD2-2-3与肺腺癌临床特征的相关性及其在肺腺癌细胞中的生物学特性。肺腺癌细胞中lncRNA PKD2-2-3表达上调促进肺腺癌细胞的增殖和克隆形成能力,还可能通过调控肺腺癌的EMT进而影响肺腺癌细胞的侵袭和迁移能力。本研究初步探讨了lncRNA PKD2-2-3在肺腺癌生物学行为的影响,但具体调控机制还有待于后续进一步研究。
致谢
感谢中南大学李征副教授为本研究提供人支气管上皮细胞系HBE及肺腺癌细胞系A549和PC9。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SIEGEL R, MA J M, ZOU Z H, et al. Cancer statistics, 2023[J]. CA A Cancer J Clin, 2023, 73(1): 17-48.
[2] CHEN P X, LIU Y H, WEN Y K, et al. Non-small cell lung cancer in China[J]. Cancer Commun (Lond), 2022, 42(10): 937-970.
[3] CHI Y J, WANG D, WANG J P, et al. Long non-coding RNA in the pathogenesis of cancers[J]. Cells, 2019, 8(9): 1015.
[4] GE X L, LI G Y, JIANG L, et al. Long non-coding RNA CAR10 promotes lung adenocarcinoma metastasis via miR-203/30/ SNAI axis[J]. Oncogene, 2019, 38(16): 3061-3076.
[5] JIANG M, QI F, ZHANG K, et al. MARCKSL1-2 reverses docetaxel-resistance of lung adenocarcinoma cells by recruiting SUZ12 to suppress HDAC1 and elevate miR-200b[J]. Mol Cancer, 2022, 21(1): 150.
[6] ZHANG L, MA D L, LI F J, et al. Lnc-PKD2-2-3/miR- 328/GPAM ceRNA network induces cholangiocarcinoma proliferation, invasion and 5-FU chemoresistance[J]. Front Oncol, 2022, 12: 871281.
[7] QIU G C, MA D L, LI F J, et al. Lnc-PKD2-2-3, identified by long non-coding RNA expression profiling, is associated with pejorative tumor features and poor prognosis, enhances cancer stemness and may serve as cancer stem-cell marker in cholangiocarcinoma[J]. Int J Oncol, 2019, 55(1): 45-58.
[8] JIA L Q, GE X L, DU C, et al. EEF1A2 interacts with HSP90AB1 to promote lung adenocarcinoma metastasis via enhancing TGF-β/SMAD signalling[J]. Br J Cancer, 2021, 124(7): 1301-1311.
[9] HOU J, AERTS J, DEN HAMER B, et al. Gene expressionbased classification of non-small cell lung carcinomas and survival prediction[J]. PLoS One, 2010, 5(4): e10312.
[10] ROUSSEAUX S, DEBERNARDI A, JACQUIAU B, et al. Ectopic activation of germline and placental genes identifies aggressive metastasis-prone lung cancers[J]. Sci Transl Med, 2013, 5(186): 186ra66.
[11] LI T F, ZHOU S, YANG Y, et al. LncRNA MNX1-AS1: a novel oncogenic propellant in cancers[J]. Biomedecine Pharmacother, 2022, 149: 112801.
[12] FARZANEH M, GHASEMIAN M, GHAEDRAHMATI F, et al. Functional roles of lncRNA-TUG1 in hepatocellular carcinoma[J]. Life Sci, 2022, 308: 120974.
[13] FARZANEH M, NAJAFI S, ANBIYAEE O, et al. LncRNA MALAT1-related signaling pathways in osteosarcoma[J]. Clin Transl Oncol, 2023, 25(1): 21-32.
[14] ZHANG Y X, YUAN J, GAO Z M, et al. LncRNA TUC338 promotes invasion of lung cancer by activating MAPK pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(2): 443-449.
[15] TIAN H, LIAN R, LI Y, et al. AKT-induced lncRNA VAL promotes EMT-independent metastasis through diminishing Trim16-dependent vimentin degradation[J]. Nat Commun, 2020, 11(1): 5127.
[16] HASHEMI M, MOOSAVI M S, ABED H M, et al. Long noncoding RNA (lncRNA) H19 in human cancer: from proliferation and metastasis to therapy [J]. Pharmacol Res, 2022, 184: 106418.
作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言