Eur Urol:锕-225-PSMA-617在镥-177-PSMA治疗失败后的晚期转移性去势抵抗性前列腺癌中的活性和不良反应
2020-12-19 AlexYang MedSci原创
β-放射Lu-177标记的前列腺特异性膜抗原(PSMA)放射配体治疗(RLT)是转移去势抵抗性前列腺癌(mCRPC)的新选择,但其抗肿瘤效果随时间推移而降低。最近,有研究人员报告了&alph
β-放射Lu-177标记的前列腺特异性膜抗原(PSMA)放射配体治疗(RLT)是转移去势抵抗性前列腺癌(mCRPC)的新选择,但其抗肿瘤效果随时间推移而降低。最近,有研究人员报告了α-放射Ac-225-PSMA-617 RLT在Lu-177-PSMA后恶化的mCRPC中的安全性和活性情况。

研究共有26名患者根据使用协议进行治疗。Ac-225-PSMA-617每8周给药一次,直到出现进展/不可耐受的不良反应。研究人员共进行了61个周期的Ac-225-PSMA-617(周期中位数2;活性中位数9MBq)。17/26名患者的PSA下降≥50%。PSA-PFS、cPFS和OS期中位数分别为3.5(95%CI 1.8-11.2)、4.1(95%CI 3-14.8)和7.7(95%CI 4.5-12.1)个月。肝脏转移与更短的PSA-PFS(中位数1.9 vs 4.0个月;p=0.02)、cPFS(中位数1.8 vs 5.2个月;p=0.001)和OS(中位数4.3 vs 10.4 个月;p=0.01)相关。血液学3/4级毒性为贫血(35%)、白细胞减少(27%)和血小板减少(19%)。所有患者均出现1/2级排异反应。分别有2名和6名患者因血液学毒性和口腔干燥症而停止治疗。研究的局限性是回顾性设计。
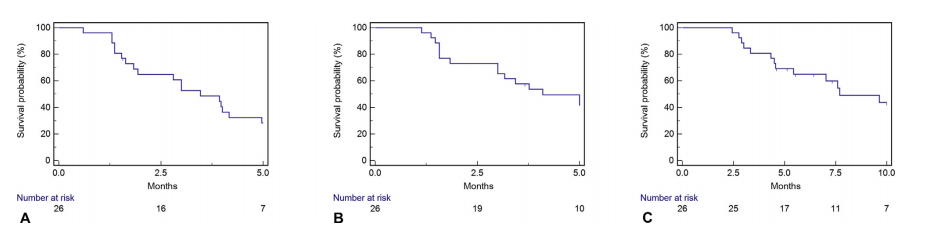
起始Ac-225-PSMA-617 RLT治疗后的PSA-PFS、cPFS和总生存
最后,研究人员指出,Ac-225-PSMA-617在Lu-177-PSMA失败后对晚期mCRPC有可测量的抗肿瘤效果。但高达三分之一的患者出现了3/4级血液学副作用,相关数量的患者出现了口腔干燥症导致治疗停止。
原始出处:
Benedikt Feuerecker , Robert Tauber, Karina Knorr et al. Activity and Adverse Events of Actinium-225-PSMA-617 in Advanced Metastatic Castration-resistant Prostate Cancer After Failure of Lutetium-177-PSMA. Eur Urol. Dec 2020
作者:AlexYang
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#抗性#
30
#治疗失败#
53
#不良反应#
51
#去势抵抗性前列腺癌#
24
#转移性#
37