Science:小胶质细胞的功能再次被挖掘!研究揭示其参与神经病理性疼痛的缓解
2022-09-16 brainnew神内神外 brainnew神内神外
周围神经损伤通过影响神经元和胶质细胞,导致神经病理性疼痛的发生。其中,脊髓后角的小胶质细胞不仅在形态和数量上发生改变,而且在基因表达谱上表现出多种细胞群。
周围神经损伤通过影响神经元和胶质细胞,导致神经病理性疼痛的发生。其中,脊髓后角的小胶质细胞不仅在形态和数量上发生改变,而且在基因表达谱上表现出多种细胞群。过往研究主要着重于疼痛的发生、发展和持续,而神经病理性疼痛通过何种机制达到自发缓解,尚未可知。
2022年3月31日,九州大学药学研究院Makoto Tsuda教授团队在Science 发表Report,利用外周神经损伤小鼠模型,揭示了脊髓后角CD11c+小胶质细胞通过胰岛素样生长因子1(IGF1)参与疼痛的自发缓解。

CD11c+小胶质细胞对于
神经病理性疼痛的自发缓解是必要的
研究人员首先利用Itgax-Venus小鼠(Itgax编码CD11c)构建外周神经损伤模型(PNI),发现PNI显著升高Venus+细胞数量,且Venus局限表达于IBA1+、CD11b+、P2Y12R+、HexbtdT/tdT小鼠(Hexb局限表达于小胶质细胞)的tdT+细胞。
作为补充数据,研究人员还利用骨髓嵌合小鼠和脾脏切除小鼠,排除了CD11c表达于外周来源细胞的可能性。因此,PNI导致的CD11c+细胞为小胶质细胞。
流式细胞术结果显示,PNI术后第14天,CD11c+小胶质细胞达峰,直到第56天一直保持在高水平。且CD11chigh小胶质细胞在第35天达峰(该时间点的逃避阈值已经恢复到基线水平)。相反,CD11cneg小胶质细胞数量在第35天时已与对照组无明显差异。以上结果说明CD11c+小胶质细胞在疼痛发生后出现,且在疼痛缓解后仍持续存在。
研究人员进一步利用Itgax-DTR-EGFP小鼠,在PNI第14天后通过鞘内注射DTX特异性去除CD11c+小胶质细胞,发现去除CD11c+小胶质细胞的小鼠没有表现出自发疼痛缓解。该结果说明CD11c+小胶质细胞对于神经病理性疼痛的自发缓解是必要的。
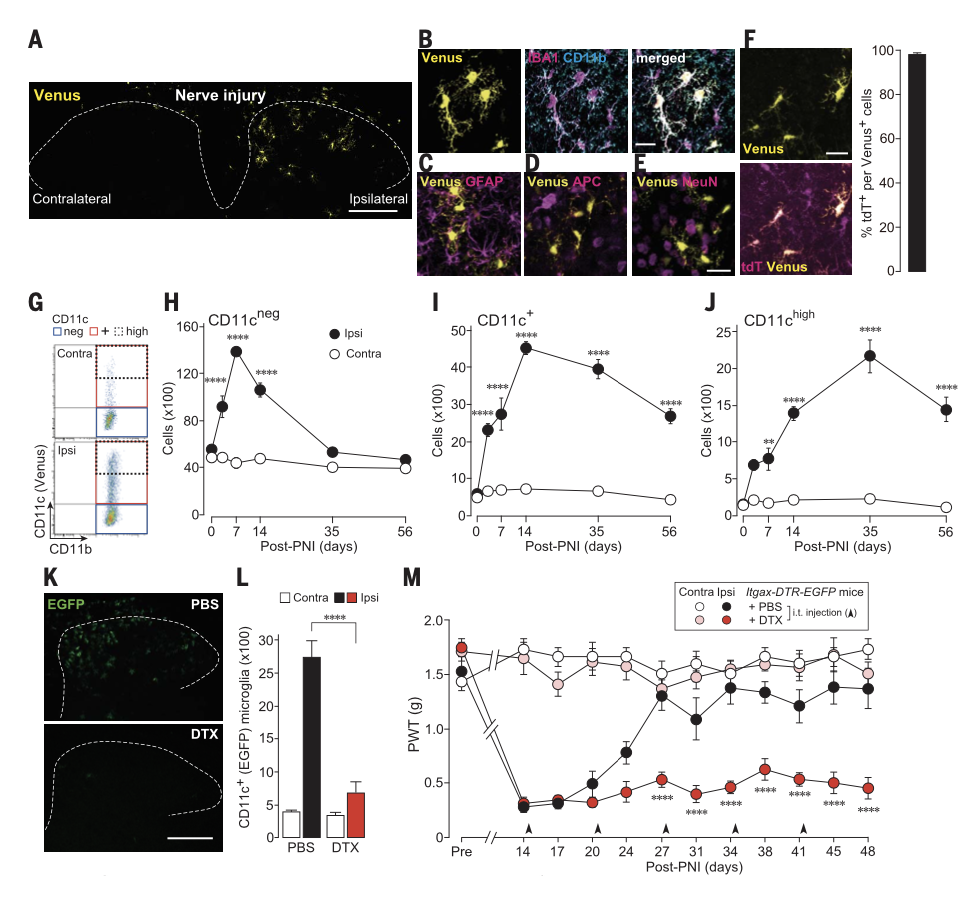
图1:脊髓CD11c+小胶质细胞对于疼痛自发缓解的必要性
CD11c+小胶质细胞
通过IGF1导致疼痛自发缓解
为了探究CD11c+小胶质细胞通过何种分子发挥作用,研究人员对PNI后脊髓中的CD11chigh和CD11cneg小胶质细胞进行了RNA测序,结果表明CD11chigh中的Igf1表达量显著高于CD11cneg。
利用Itgax-Cre;Igf1flox/flox小鼠特异性去除CD11c+小胶质细胞、利用Cx3cr1CreERT2;Igf1flox/flox小鼠特异性敲除小胶质细胞中的Igf1、或在野生型小鼠鞘内注射IGF1中和抗体,均显著抑制了PNI第14天后的疼痛自发缓解。相反,在野生型小鼠鞘内注射IGF1显著增强了疼痛自发缓解。
以上结果表明,CD11c+小胶质细胞中升高的IGF1对于疼痛自发缓解是必要的。
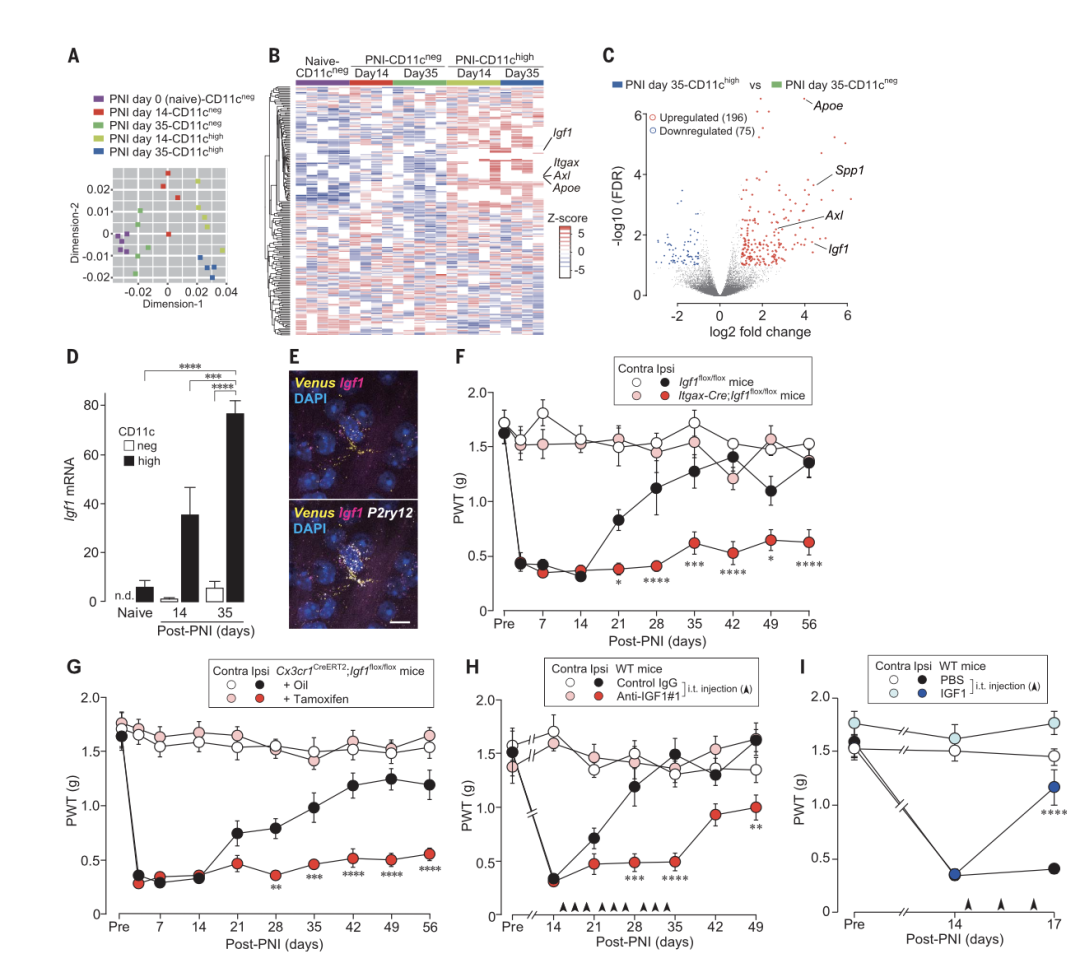
图2:CD11c+小胶质细胞中的IGF1对于疼痛自发缓解的必要性
髓鞘吞噬导致CD11c+
小胶质细胞的增加
那么,什么导致了CD11c+小胶质细胞的增加?研究人员发现足底注射saporin-CTB(损伤有髓神经纤维)导致了脊髓CD11c+小胶质细胞的增加,而足底注射saporin-IB4(损伤无髓神经纤维)则没有。且PNI导致CD11c+小胶质细胞表达吞噬相关基因。因此,研究人员猜想CD11c+小胶质细胞的增加可能与吞噬髓鞘相关。
分离PNI后的CD11c+小胶质细胞进行体外培养,研究人员发现该细胞对髓鞘的吞噬显著升高;免疫组化显示PNI后MBP与Venus(显示CD11c表达)、CD68(显示溶酶体)共标;电镜图片显示吞噬了髓鞘颗粒的CD11c+小胶质细胞。脊髓中注射髓鞘碎片导致了CD11c+小胶质细胞的增加。
另外,与髓鞘吞噬相关的Axl在CD11c+小胶质细胞中显著升高。敲除Axl显著降低了CD11c+小胶质细胞数量和Igf1的表达,且抑制了疼痛自发缓解。
因此,以上结果表明,Axl可能通过髓鞘吞噬导致CD11c+小胶质细胞的增加。

图3:Axl导致CD11c+小胶质细胞的增加
特异性去除CD11c+小胶质细胞
导致疼痛复发
PNI第35天后,逃避阈值已恢复至基线水平。此时,研究人员利用Itgax-DTR-GFP小鼠特异性去除CD11c+小胶质细胞后,逃避阈值显著降低,即疼痛复发。
类似地,利用Cx3cr1CreERT2;Igf1flox/flox小鼠在PNI第37、39天特异性敲除小胶质细胞中的Igf1、或在野生型小鼠鞘内注射IGF1中和抗体,均导致了疼痛复发。
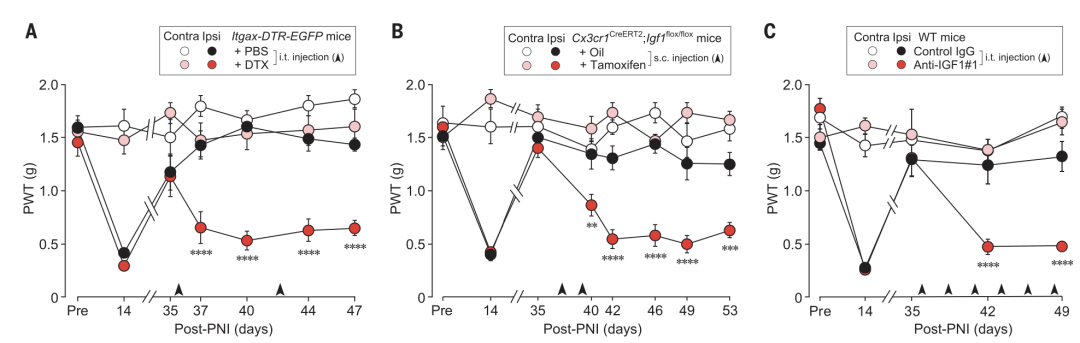
图4:在PNI疼痛自发缓解后去除CD11c+小胶质细胞导致疼痛复发
总 结
综上,该研究揭示了CD11c+小胶质细胞通过IGF1,在神经病理性疼痛的后期发挥抑制疼痛的作用,达到疼痛自发缓解。这种自发缓解并不是病理状态的消失,而是一种动态平衡。对CD11c+小胶质细胞和IGF1的功能进行深入研究,有望产生疼痛治疗新靶点。
与过往研究充分揭示了小胶质细胞在神经病理性疼痛中的“致痛”作用所不同,该研究揭示了还存在发挥“镇痛”作用的小胶质细胞亚群,为小胶质细胞的异质性提供了证据,也启示我们重新审视小胶质细胞的功能。
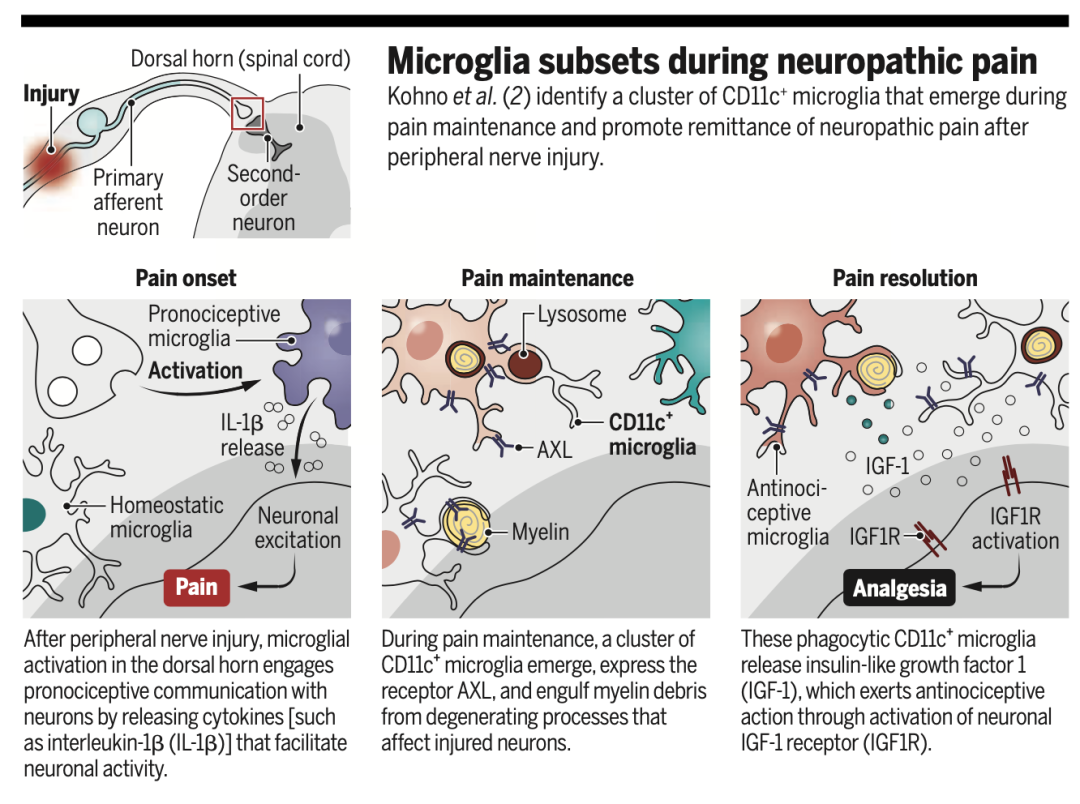
图5:神经病理性疼痛中的不同小胶质细胞亚群
作者:brainnew神内神外
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#神经病理性#
60
非常好
72
#神经病理性疼痛#
85
#SCIE#
95
#胶质细胞#
95