Cell Death Differ:miR-30d抑制有氧糖酵解作用抑制胰腺癌的发生
2021-05-24 xiaozeng MedSci原创
胰腺导管腺癌(PDAC)作为最致命的人类癌症之一,其特点是高糖酵解速率,以确保其在营养不良高缺氧的微环境中仍能够发展。
胰腺导管腺癌(PDAC)作为最致命的人类癌症之一,其特点是高糖酵解速率,以确保其在营养不良高缺氧的微环境中仍能够发展。PDAC中的糖酵解通过产生大量底物并通过糖酵解酶和肌动蛋白的相互作用,以促进细胞的侵袭和迁移,从而支持肿瘤细胞的旺盛生长。
此外,糖酵解的重要酶和中间体可通过参与上皮-间质转化(EMT)进程、血管生成和定植相关信号转导或表观遗传学调控,以调节PDAC的转移。然而,关于PDAC细胞促进有氧糖酵解以维持其代谢需要的机制仍知之甚少。
miRNA是一类非编码的小RNA,其能够通过靶向特定的mRNA并诱导其降解或翻译抑制而对基因的表达产生负调控作用。既往研究显示,miRNA介导的基因调控在PDAC的发生发展和病理以及代谢异常中的重要性。目前也已发现miRNA在包括结直肠癌、肝癌、胰腺癌和肺癌等多种肿瘤的增殖和转移中的作用,且miRNA的异常表达已被证实与癌细胞的高度增殖、迁移和侵袭性表型相关。
miR-30d的表达与PDAC患者较好的预后相关
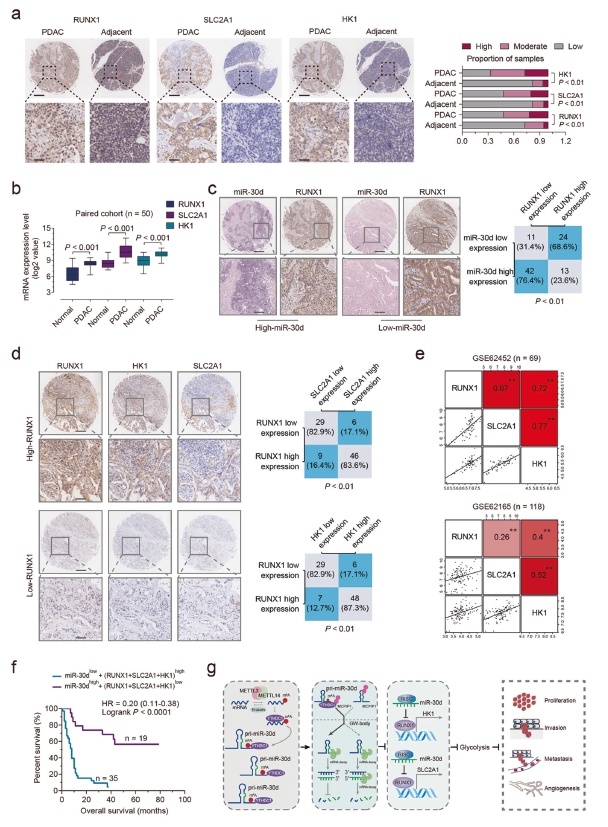
在该研究中,研究人员发现miR-30d是一种糖酵解相关的miRNA,其可以抑制PDAC的恶性表型并独立预测患者的生存结果。研究人员发现在PDAC组织中miR-30d的表达显著降低,且与患者良好的预后相关,其有助于抑制肿瘤的生长和转移,并减弱Warburg效应。
PDAC患者中miR-30d/RUNX1/SLC2A1/HK1通路的临床意义
机制研究显示,m6A阅读器YTHDC1能够通过m6A介导的mRNA稳定性调节,促进成熟miR-30d的产生。miR-30d通过直接靶向与SLC2A1和HK1基因的启动子区域结合的转录因子RUNX1来调节SLC2A1和HK1的表达,进而抑制有氧糖酵解作用。此外,在临床上,miR-30d与RUNX1、SLC2A1和HK1呈负相关,后者为PDAC组织整体生存的不良预后因素。
总而言之,该研究证实了miR-30d是PDAC中的功能性和临床抑癌基因。且进一步揭示了YTHDC1通过m6A修饰促进miR-30d的表达,并通过抑制有氧糖酵解作用抑制胰腺癌的发生。
原始出处:
Hou, Y., Zhang, Q., Pang, W. et al. YTHDC1-mediated augmentation of miR-30d in repressing pancreatic tumorigenesis via attenuation of RUNX1-induced transcriptional activation of Warburg effect. Cell Death Differ (21 May 2021).
作者:xiaozeng
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#CEL#
40
#Cell#
40
#miR#
32
#Differ#
34
#糖酵解#
41