全球第6款PD-1/PD-L1肿瘤免疫疗法获批上市,竞争趋白热化!
2018-10-06 MedSci MedSci原创
赛诺菲与合作伙伴再生元近日联合宣布,美国食品和药物管理局(FDA)已批准肿瘤免疫疗法Libtayo(cemiplimab-rwlc),用于皮肤鳞状细胞癌(CSCC)的治疗,包括:(1)转移性CSCC患者;(2)不适合根治性手术或根治性放疗的CSCC患者。监管方面,FDA已授予Libtayo治疗CSCC的突破性药物资格和优先审查资格。此次批准,使Libtayo成为美国市场首个也是唯一一个获批专门治疗
赛诺菲与合作伙伴再生元近日联合宣布,美国食品和药物管理局(FDA)已批准肿瘤免疫疗法Libtayo(cemiplimab-rwlc),用于皮肤鳞状细胞癌(CSCC)的治疗,包括:(1)转移性CSCC患者;(2)不适合根治性手术或根治性放疗的CSCC患者。监管方面,FDA已授予Libtayo治疗CSCC的突破性药物资格和优先审查资格。
此次批准,使Libtayo成为美国市场首个也是唯一一个获批专门治疗晚期CSCC的药物,同时该药也是成功登陆市场的第6款PD-(L)1肿瘤免疫疗法。在欧盟方面,Libtayo治疗相同适应症也在接受欧洲药品管理局(EMA)的审查。
据悉,Libtayo将以350mg单剂量小瓶装上市销售,推荐用药剂量为每3周一次静脉输注350mg,输注时间需至少30分钟,治疗直至病情进展或不可接受的毒性。定价方面,Libtayo每3周一个治疗周期的批发采购成本为9100美元,但由于该定价并没有考虑保险覆盖、共同支付、患者支持项目等因素,因此预计患者的实际费用将下降。
CSCC是第二大最常见类型皮肤癌。据估计,在美国每年有7000人死于CSCC。目前,CSCC约占美国所有皮肤癌病例的20%,新诊病例数预计将逐年递增。当CSCC侵入深层皮肤或邻近组织时,被归类为局部晚期CSCC。一旦扩散到身体的其他远端部位,则被归类为转移性CSCC。虽然CSCC在早期发现时具有良好的预后,但如果进展到晚期则会变得特别难以治疗,同时患者生活质量因病情影响显著下降。
Libtayo的获批对晚期CSCC患者群体而言是一个大好消息,作为一种新的免疫疗法,将帮助解决该类患者群体未满足医疗需求。
Libtayo的获批是基于一项关键性、单臂、开放标签II期临床研究(EMPOWER-CSCC-1,Study 1540)以及一项I期临床研究(Study 1423)中2个晚期CSCC扩展队列的数据。这些研究入组的患者均为转移性CSCC患者以及不适合手术切除的局部晚期CSCC患者,汇总的疗效数据如下图所示:
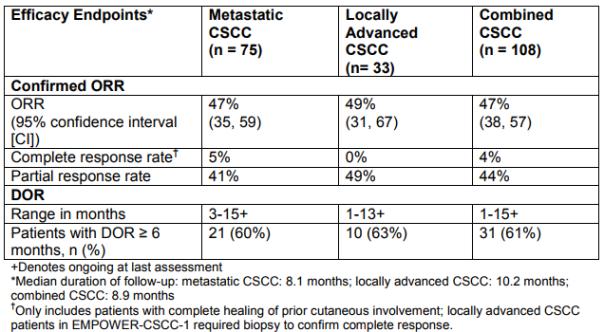
全球6款PD-(L)1肿瘤免疫疗法
Libtayo属于PD-(L)1免疫疗法,其活性药物成分cemiplimab是一种靶向免疫检查点PD-1(程序性细胞死亡蛋白-1)的全人源化单克隆抗体,该药由再生元专有的Velocimmune技术平台创造并优化而成,目前正与赛诺菲进行全球开发。除了CSCC适应症之外,双方也正在开发cemiplimab的其他适应症,包括基底细胞癌(BCC)以及一二线治疗非小细胞肺癌(NSCLC)等。
PD-(L)1免疫疗法是当前备受瞩目的一类肿瘤免疫疗法,此前,市面上已有5款PD-(L)1肿瘤免疫疗法,分别为默沙东的Keytruda(PD-1)、百时美施贵宝的Opdivo(PD-1)、罗氏的Tecentriq(PD-L1)、阿斯利康的Imfinzi(PD-L1)、辉瑞/默克的Bavencio(PD-L1)。
在中国市场,百时美Opdivo(中文商品名:欧狄沃,通用名:纳武利尤单抗,民间俗称:“O”药)率先于2018年6月15日获得中国药品监督管理局批准,成为国内上市的首个PD-(L)1肿瘤免疫疗法,适应症为:治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性NSCLC成人患者。
今年7月25日,默沙东Keytruda(中文商品名:可瑞达;通用名:帕博利珠单抗,民间俗称:“K”药)也顺利通过中国药品监督管理局批准,适应症为:一线治疗失败的不可切除性或转移性黑色素瘤。
今年8月20日和9月19日,双方分别公布了各自药物在中国内地的建议零售价,由此掀起了一场激烈的价格战。默沙东方面,对于低收入患者有买3赠3的赠药政策,一年费用只要16万人民币,而对于低保户则可免费试用24个月。
与此同时,罗氏、阿斯利康、辉瑞/默克也在加速推进中国市场的研发进度,3家的产品预计2020年之前均能在国内上市。如此强力的竞争,给包括恒瑞、百济神州等在内的国内相关企业带来了不小的压力。
参考来源:
Sanofi : FDA approves Libtayo® (cemiplimab) as first and only treatment for advanced cutaneous squamous cell carcinoma
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#获批上市#
58
#PD-L1#
64
#肿瘤免疫疗法#
90
了解一下谢谢
110