Biomaterials:肥大软骨细胞移植物能够促进长骨修复
2017-07-17 徐月 BioArt
骨头具有损伤后自修复功能,可是,大规模复杂断裂可能会超出骨头的自然修复承受力,导致骨不连,需要外加干预来促进骨再生。移植组织工程制造的骨头是一种非常有潜力的治疗方法,但目前主要采用的是膜内成骨(由成骨细胞成骨),然而大多数严重的骨损伤修复机制为软骨成骨(软骨基质增厚重新塑性成骨)。干细胞分化为肥大软骨细胞,这是软骨硬化成骨的重要一步,但一直以来没有被研究者开发用于长的骨缺陷修复。基于此,Gorda
摘要
骨头具有损伤后自修复功能,可是,大规模复杂断裂可能会超出骨头的自然修复承受力,导致骨不连,需要外加干预来促进骨再生。移植组织工程制造的骨头是一种非常有潜力的治疗方法,但目前主要采用的是膜内成骨(由成骨细胞成骨),然而大多数严重的骨损伤修复机制为软骨成骨(软骨基质增厚重新塑性成骨)。干细胞分化为肥大软骨细胞,这是软骨硬化成骨的重要一步,但一直以来没有被研究者开发用于长的骨缺陷修复。基于此,Gordana Vunjak-Novakovic课题组研发了以人类脂肪干细胞(ASC)为原料的组织工程移植体,这一工作于2017年5月发表于Biomaterials[1]。ASC是一种临床上可用的细胞源,可以分化成肥大软骨细胞,生长在脱细胞骨支架上,然后移植到有骨缺陷的无胸腺大鼠身上。实验表明这种移植体在大鼠体内发生了软骨骨化,表明将ASC衍生的肥大软骨细胞接种在骨支架上,有助于长骨修复。
背景介绍
据估计,在美国每年有十万例病人遭受自身修复能力难以承受的骨折,并且没有得到治愈[2]。想要有效治愈骨不连,就需要外加干预,很多时候会进行骨移植手术。在移植手术中,自体移植物和异体移植物相比,能够促进创伤愈合成骨,需要重新手术修正的比例也小得多。尽管自体移植有很多好处,然而在临床上用的很少,这主要是因为缺乏适合的自体骨。于是研究人员想到了利用病患的干细胞培养自体移植骨,而不是从病患体内取别的骨头进行移植[3]。然而这种方法在长骨修复的病例中治疗结果喜忧参半。
我们的身体在进行长骨修复的过程中,利用的是软骨骨化。此过程起始于间叶干细胞形成软骨基质,进一步这种细胞分化为成熟的肥大软骨细胞,使得软骨基质变为骨模板,诱导脉管系统和骨髓形成[4]。由于自体移植有如此的优越性,同时以往的细胞加生长因子疗法又有许多局限性,本研究的目标是制造一种可临床使用,可控并且可再生的长骨修复组织。
实验方法
首先制备脱细胞支架。从幼体牛腰部取出骨小梁,切成直径4毫米高度6毫米的圆柱体。选取疏松程度相近的骨质,用多种溶液灌流,再用蛋白质酶、DNA酶和RNA酶溶液处理,去除原生细胞,得到脱细胞支架。
然后将细胞回植到脱细胞支架中。从病患体内获得脂肪组织并提取出脂肪干细胞。细胞在培养基中扩增,将先前制得的脱细胞支架在70%乙醇中浸泡两天,然后在无菌培养基中浸泡一天。将脂肪干细胞从培养皿中消化下来,植入干燥后的脱细胞支架中。
接着将栽种了细胞的支架在扩增培养基中培养2天,使得细胞能够贴附,继续添加诱导分化物和生长因子,使干细胞分化成熟,并且增殖形成实验组移植物,培养过程为5周。而对照组移植物则是在乙醇中浸泡了两天后储存在磷酸盐缓冲液中的脱细胞支架,5周后同时进行移植手术。
本实验用到的是无胸腺(免疫系统缺陷)大鼠,将其麻醉后在右侧股骨头用线锯制造一个5mm长的创口,将制备好的移植物植入创口处并缝合。另有4只大鼠没有植入移植物,以观察不愈合骨损伤带来的影响。
实验结果
向培养基中添加诱导因子,使得骨支架中的脂肪干细胞分化成为肥大软骨细胞和成骨细胞。静态培养(H组)是通过干细胞与软骨组织共培养诱导分化(2周),然后加入生长因子使细胞增厚成熟(3周)。(图1.B右图)另一组(O组)采用了间隙流动方式使干细胞分化为成骨细胞。(图1.B左图)

图1. 实验过程示意图
在五周的培养过程后,H组表现出了类似软骨组织的性质,软骨细胞和肥大软骨细胞相关基因表达上调,表达量高于O组(图2.A),类骨质和组织基质(图2.B黑色箭头指向处,在黄色细胞支架上表现为红色)在所制备的移植体上形成,并且O组的类骨质沉积要比H组多。然而肥大软骨细胞在支架上的软骨基质中的沉积,H组更多,分布更广,在胶原基质上的沉积量也更多。(图2.C绿色为软骨素中的糖胺聚糖,红色为胶原蛋白纤维)骨唾液蛋白(BSP),作为骨头矿物化过程的重要因子,在移植物中的沉积分布与基质性质相吻合:H组中分布在软骨组织附近,而O组中分布在胶原纤维附近。(图2.D)骨桥蛋白,另一种成骨过程中的重要蛋白,在H组中同样可以在软骨基质附近找到,然而在O组中几乎找不到。因此在培养完成移植时,H组移植物与O组相比,已经有更高的骨相关基因表达量,成骨相关蛋白也更多。
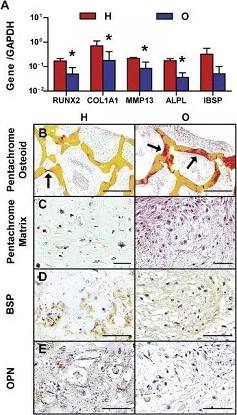
图2.骨移植物体内表征
移植手术后3周,H组移植物已经开始和原生骨相容,并且有大量矿物质沉积,然而O组只有少量骨相容,并没有发现矿物质沉积。Con为没有回植细胞的脱细胞支架对照组。6周后差异更加明显,H组移植物与两端骨相容的部分增加,然而O组只在端部有少量相容,对照组的矿物沉积更多了,然而表现为碎片化,只有很少量的骨质在脱细胞支架和缺陷处形成。12周之后,H组骨连接达到了原缺陷的7/8,而对照组为3/8,O组只有1/8。

图3.移植后各组CT造影图
图4.骨质形成与再生。A.新生骨质(NB)标记为桃红色,植入的细胞支架(DCB)标记为浅粉色,纤维组织(FT)为黄色。B.将视野放大后可以看到骨髓(BM),标记为蓝色,钙化的软骨组织(CC,深紫色)。C.软骨组织染为绿色,新骨为黄色,在三组中都发生了软骨钙化。
在O组和对照组中,原生股骨头边缘发生了软骨钙化,而在H组中,这一现象可以在整个移植体中观察到。H组中钙化的软组织和形成的骨髓都多余于两组,而纤维化组织更少,表明了骨再生程度高。
讨论与总结
自体移植骨的组织工程研究对于创伤后骨不连有很好的修复潜力,针对不同病患的各种骨缺陷可以采取个性化治疗方法。然而现有临床治疗方案都有一些缺陷,例如骨相容程度差、无法完全再生、移植物力学强度不够等等[5]。本研究认为利用分化得到的肥大软骨细胞植入细胞支架可以克服这些问题。上文中已经说明,这种方案制备的移植物优越性主要体现在:1.能和原生骨很好相容;2.骨质沉积量更大;3.能够更加有效愈合骨缺陷;4.在骨缺陷周围空间形成再生环境。
原始出处:
Bernhard, J., Ferguson, J., Rieder, B.et al. Tissue-engineered hypertrophic chondrocyte grafts enhanced long bone repair.Biomaterials
作者:徐月
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录




#骨修复#
51
#细胞移植#
48
#软骨细胞#
53
#Biomaterials#
53
#植物#
55