Nat Cell Biol:新一代单细胞itChIP技术解析早期胚胎细胞命运决定机制
2019-09-05 佚名 中国生物技术网
2019年9月3日,北京大学分子医学研究所、北大-清华生命科学联合中心何爱彬组在《Nature Cell Biology》在线发表了题为Profiling chromatin state by single-cell itChIP-seq的文章,报道了利用一种全新的普适性,易操作的单细胞ChIP-seq技术解析早期胚层和器官发育中细胞命运的选择决定机制,并将这一方法命名为itChIP(simult
多细胞生物体由具有相同基因组的不同细胞类型组成,在器官组织发育过程中,细胞状态和细胞命运决定的机制一直是领域普遍关心的问题。 无论在发育过程还是疾病状态下,表观遗传因素(不改变DNA序列的情况下)在细胞命运决定中起着指导性作用。细胞类型和功能异质性往往通过调控基因表达来实现。目前研究多集中在单细胞转录组水平,单细胞水平解析表观调控机制也鲜有报道,而从单细胞、全基因组范围研究组蛋白修饰和转录因子如何控制细胞谱系发生、命运决定则尚属空缺。
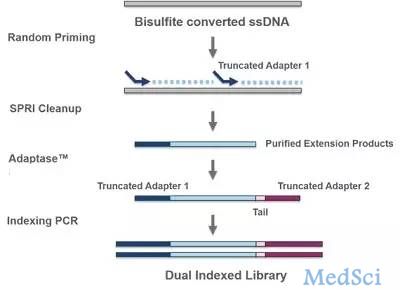
研究这一问题,需要在单细胞水平解析全基因组范围内DNA-蛋白质的相互作用图谱,染色质免疫共沉淀(ChIP-seq)技术是捕获蛋白质-DNA相互作用的有效手段,然而目前单细胞ChIP-seq技术仍面临诸多挑战,极大限制了人们对细胞命运特化的调控机制的认识。为了解决这一技术难题,何爱彬课题组利用Tn5转座酶切割DNA,切割完的DNA直接带上可供PCR扩增的DNA序列。巧妙之处在于,研究人员用甲醛交联样品,然后在高温下用SDS处理细胞,这样能使全基因组染色体变得松散,同时不会影响蛋白质与DNA的结合。在这种处理下,Tn5能均匀地切割染色体并提高抗体结合效率,而且不会产生对开放区域的偏好性。采用单细胞itChIP-seq技术,研究人员成功捕获了100,500以及10,000个细胞多种组蛋白修饰以及DNA-结合蛋白在基因组的结合图谱。通过单细胞itChIP对近2,000个上胚层样细胞(epiblast-like cells, EpiLCs)的H3K27ac(标记激活型增强子的组蛋白修饰)的信号进行分析,研究者揭示在发育过程中,外胚层和内胚层的命运可能提前决定(尚未观察到基因表达或者表型出现),而中胚层分化最后发生。为了进一步证明单细胞itChIP适用于细胞数量很少的珍贵胚胎组织样品,研究人员对胚胎期第7.75和第8.25的NKX2-5谱系的心脏细胞同时进行了单细胞的RNA-seq和单细胞H3K27ac itChIP实验。通过对这两个不同维度的单细胞数据进行整合分析,研究人员发现了在心脏干细胞向心肌细胞和内皮细胞两个不同谱系分化过程中,增强子表现出谱系特异性的激活和关闭。虽然基因表达呈现出平滑的逐渐上调和下调(线性变化)的渐变趋势,但是增强子却表现出骤变式(指数级变化)的激活或者失活,这一现象说明增强子比其调控的基因表现出更强的时空特异性。因此,单细胞itChIP不仅适用于上千个单细胞的捕获,同时也可用于捕获起始量只有几十个单细胞的样品,这为研究稀少细胞样品例如植入前胚胎等的表观调控异质性提供了新的技术手段。
北京大学分子医学研究所博士生艾珊珊和北大-清华生命科学联合中心博士生熊海清为论文共同第一作者,何爱彬研究员为本文的通讯作者。该研究获得了科技部干细胞专项、国家自然科学基金委的和生命科学联合中心的支持。
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Bio#
52
#CEL#
49
#解析#
59
#Biol#
49
#Cell#
55