Nat Med:预测疾病风险,孕育健康婴儿!全基因组重建助力优选胚胎
2022-10-27 生物探索 生物探索
随着PRS预测能力的提高,以及测序技术变得更具成本效益,相信PRS和PGT技术的联用,可以为具有常见疾病家族史的夫妇进行体外受精的胚胎的疾病风险进行建模。
导语:辅助生殖技术的迅速发展给全世界很多家庭带来了福音,胚胎植入前基因检测(Preimplantation genetic testing,PGT)已经成为提高妊娠成功率最有价值的手段之一。PGT可以有效降低异常妊娠和出生缺陷,但目前还是无法结合常见变异和罕见变异对胚胎进行更全面的遗传学评估。对此,来自美国MyOme公司的研究团队扩展了全基因组重建(Whole-genome reconstruction,WGR)策略,通过使用亲本基因组测序和胚胎基因分型来预测胚胎的遗传基因组序列,以预测常见疾病的发生风险。
PGT是指在胚胎植入前筛查胚胎染色体,以排除携带遗传疾病及染色体异常的胚胎,该方法可直接淘汰问题胚胎,挑选遗传物质正常的胚胎进行植入,可以从遗传角度有效减少出生缺陷。其可以在植入前对胚胎进行家族特异性遗传疾病的分析,部分研究团队已经将其探索范围扩大到包括心脏病和癌症在内的常见疾病。但是由于胚胎活检中DNA的数量和质量有限,全面分析胚胎基因组成本高昂且耗时多,存在与等位基因缺失相关的不精确性,需要扩大亲属检测样本或依赖插补,这阻碍了BRCA1等基因中罕见有害变异的检测。
全基因组重建或可用于植入前
胚胎多种常见疾病的风险预测
为了克服PGT的固有限制,来自美国MyOme公司的研究团队扩展了WGR策略,该策略使用亲本基因组测序和胚胎基因分型来预测胚胎的遗传基因组序列。他们将此种方法应用于10对夫妇的110个胚胎,并计算了12种疾病的多基因预测因子,包括癌症、心脏代谢和自身免疫性疾病。该研究团队的研究结果以“Whole-genome risk prediction of common diseases in human preimplantation embryos”为题,发表在Nature Medicine上。

图1 研究成果(图源:[1])
研究人员在该项研究中使用的样本来自之前根据机构审查委员会协议进行过体外受精的夫妇,这些夫妇都进行过临床PGT。DNA样本取自10名获得PGT结果的出生婴儿,非整倍体临床PGT(PGT-A)显示,110个胚胎中有68个是整倍体,有42个有一个或多个非整倍染色体。通过对父母进行高覆盖率基因组测序,并对同胞胚胎进行阵列测量来实现胚胎的WGR。
他们采用分子和统计方法相结合的方法,将亲本变异体连接成对应于单个整倍体染色体的“单倍型”,确定每个胚胎的减数分裂重组位点,并在每个重组位点之间组装相关的单倍型片段,以近似整个遗传胚胎基因组。
接着,研究人员将基因型预测与出生婴儿的实际基因型进行比较以评估WGR的准确性。与出生婴儿相比,全基因组预测准确率从第3天胚胎活检的96.3-98.4%,到第5天胚胎活检的98-98.9%不等。
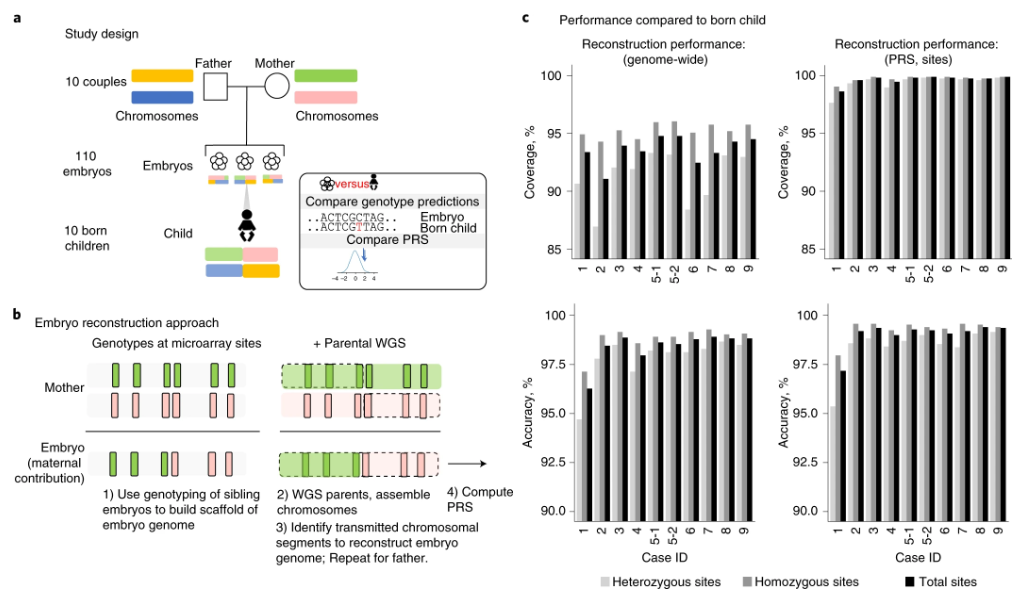
图2 WGR流程(图源:[1])
为了探索WGR在预测常见疾病风险中的准确性,研究人员使用重建的胚胎基因组计算多基因风险评分(Polygenic risk score,PRS),他们观察到在第5天胚胎活检病例中,与多基因风险评分相关的位点基因型准确率为99-99.4%,而在第3天囊胚活检病例中为97.2-99.1%。
研究人员将每个胚胎的PRS标准化,并使用逻辑回归模型将分数转换为疾病风险,基于基因组,预测胚胎可能在几十年后对包括癌症、自身免疫性疾病等常见疾病的易感性。
研究人员检查了在PGT背景下使用单基因和多基因变体的潜在影响,在一对有乳腺癌家族史且因单基因疾病接受PGT的夫妇中,发现了母亲先前发现的致病性BRCA1变异。在该家族的20个整倍体胚胎中,预测有13个胚胎携带致病性BRCA1变异。在基因组重建后,预测的乳腺癌遗传风险在胚胎中变化了15倍,OR范围从0.35到5.35。
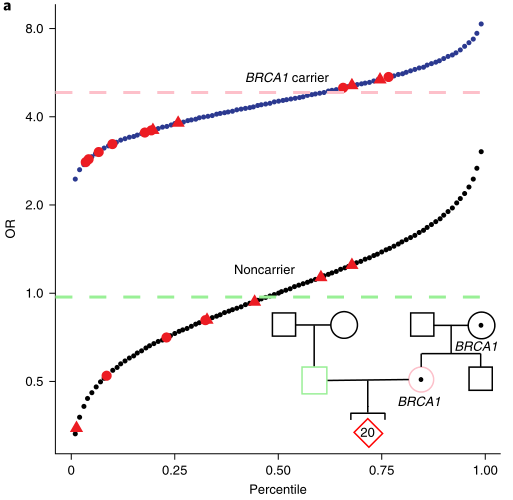
图3 对有乳腺癌家族史、BRCA1变异和多个胚胎的研究参与者进行综合多基因/单基因预测(图源:[1])
综上,这项临床前研究证明了胚胎的WGR是可行的,能够准确计算PRS。利用WGR对常见变异进行PRS计算,结合罕见变异,可以较为准确地预测多种常见疾病的风险。
有效预测疾病风险,方能孕育健康婴儿
截止目前,已知的单基因遗传病有8000多种,如果能够及时干预和预防,或许可以有效避免不良结局的产生,孕育出健康婴儿。PGT技术为优生优育提供了有效支持,其包括PGT-A、PGT-M、PGT-SR。
对于高龄生育人群、反复流产人群、精子头部畸形人群来说,应首选着重检测染色体非整倍体的第一道防线——PGT-A。女性超过36岁,胚胎非整倍体的比例超过35%,40岁以上,这一比例将高达55%,对IVF中反复失败的群体进行PGT-A检测,优选后胚胎移植的妊娠成功率从21.2%上升至68.3%;通过PGT-A技术可以减少因非整倍体导致的流产;精子形态学评估中头部畸形的男性可以通过PGT-A筛查,提高妊娠率。
PGT-M可精准狙击单基因遗传病,对于血友病、多囊肾、地中海贫血、杜氏肌营养不良这些明确单基因致病,且具有家族史的遗传病,需要进行及时筛查。在怀孕前进行PGT-M筛查,该项技术可以提前筛查出问题胚胎,进而有效降低所生育后代的重型单基因病的患病风险。
PGT-SR是在已知父母为某种染色体病患者的情况下,在胚胎植入前,对其进行染色体结构和数目异常检测,筛选出生育风险低的胚胎,以提高妊娠率。对染色体结构异常的夫妇进行PGT-SR检测,可以减少缺陷婴儿的出生。
此外,近年来,PGT-P技术的应用也逐渐增多,PGT-P能对受精卵进行全基因组测序和PRS,预测多种疾病风险。根据相关研究,进行过PGT-P检测而出生的婴儿,其日后患心脏病、2型糖尿病、乳腺癌和精神分裂症的风险,分别下降46%、42%、15%和34%。
结合以上研究,随着PRS预测能力的提高,以及测序技术变得更具成本效益,相信PRS和PGT技术的联用,可以为具有常见疾病家族史的夫妇进行体外受精的胚胎的疾病风险进行建模。
原始出处:
Kumar A, Im K, Banjevic M, et al. Whole-genome risk prediction of common diseases in human preimplantation embryos. Nat Med. 2022 Mar;28(3):513-516. doi: 10.1038/s41591-022-01735-0. Epub 2022 Mar 21. PMID: 35314819; PMCID: PMC8938270.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言