知临集团有限公司已获得美国 FDA 批准试验用新药的申请,启动用于治疗神经母细胞瘤的再利用小分子药物 SACT-1 的临床试验
2021-09-16 国际文传 网络
知临集团有限公司一家专注于包括靶向肿瘤疾病在内的新技术的临床阶段生物制药公司
知临集团有限公司(纳斯达克股票代码:APM,巴黎泛欧交易所股票代码:APM)(“知临集团”或“知临”),一家专注于包括靶向肿瘤疾病在内的新技术的临床阶段生物制药公司,宣布该集团已获得美国食品药品监督管理局 (“FDA”) 批准试验用新药 (“IND”) 的申请,可启动 SACT-1 的临床试验。SACT-1 是一种用于治疗神经母细胞瘤的口服改用小分子药物。
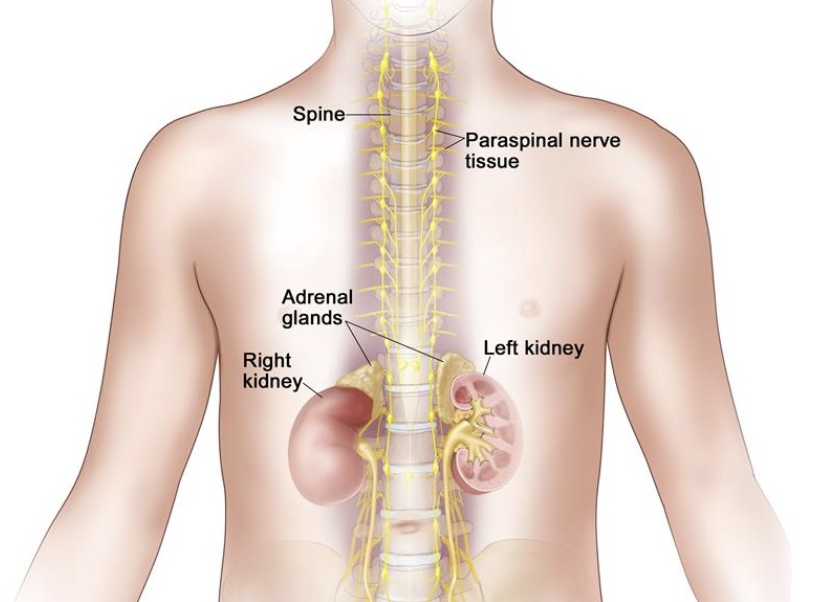
知临集团首席医疗总监兼执行董事郑子俊医生评论道:“继我们目前ALS-4 的临床试验计划以外,我们很高兴地宣布美国 FDA 已批准我们的IND申请并可启动 SACT-1 的临床试验。这是公司的另一个重要里程碑,也是 2021 年有针对性的战略目标之一。这一里程碑支持知临集团在美国的重点,并反映了我们产品的科学严谨性和崭新方法的潜力。神经母细胞瘤是一种高度未得到满足的实体瘤,主要发生在儿童患者的脑外神经系统中。神经母细胞瘤的临床行为变化很大,大多数病例具有高度侵袭性。我们相信 SACT-1 有可能有效地针对这种疾病并解决这种疾病未得到满足的需求。”
根据先前美国 FDA 在我们的 IND 前会议上提供的建议, IND 开放临床试验将会是一项生物利用度/食物效应的临床研究,这项研究将在美国进行,然后取决于美国 FDA 的进一步批准,我们的1b/2a 期临床试验将扩展到患有复发性或难治性高风险神经母细胞瘤的儿科患者中。IND 开放临床试验是一项相信将持续大约四个月的生物利用度/食物效应研究。生物利用度/食物效应研究的目的是比较新开发的 SACT-1 儿科制剂在健康成人受试者中的相对生物利用度。
免责声明与前瞻性陈述
本新闻稿并不构成知临集团的任何销售要约或者购买公司证券的实质约定。
本新闻稿包含有关知临集团及其未来预期、计划和前景的陈述,这些陈述构成1995年《私人证券诉讼改革法案》界定的“前瞻性陈述”。为此目的,此处包含的任何非陈述历史事实的陈述均可被视为前瞻性陈述。在某些情况下,您可以通过诸如“可以”、“应该”、“预期”、“计划”、“预计”、“可能”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、“潜在”或“继续”,或者这些术语及其他类似表达的否定形式来识别前瞻性陈述。知临集团的这些前瞻性陈述,其中包括有关申请提交和试验的预计时间表的陈述,主要基于其目前的预期及其对认为可能影响其业务、财务状况和经营业绩的未来事件和趋势的预测。这些前瞻性陈述仅反映截至本新闻稿发布之日的信息,并受若干风险、不确定性和假设的影响,包括但不限于与其宣布的管理和组织变更相关的风险、关键人员的持续服务和可用性、其通过为其他消费者细分市场提供额外产品而扩充产品线的能力、开发结果、公司预期的成长策略、业务中的预期趋势和挑战、其对供应链的期望及供应链的稳定性,以及知临集团的20-F表格、未来知临集团可能向SEC提交的其他文件,以及于2020年7月16日获得法国第20-352号法国金融市场专员的招股说明书中更加充分描述的风险。
因此,这些前瞻性陈述中包含的预测可能会发生改变,实际结果可能与此处所述存在重大差异。知临集团不承担因新信息、未来事件或其他原因而更新本新闻稿中包含的任何前瞻性陈述的义务。
本公告不是2017年6月14日第(EU)2017/1129号条例(由2019年3月14日第(EU)2019/980号和2019年3月14日第2019/979号条例修订)定义的招股说明书。
作者:国际文传
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#小分子#
80
#母细胞瘤#
95
#细胞瘤#
76