Cancer Res:中南大学金鑫团队发现了CDK4/6改变TBK1磷酸化抑制前列腺癌STING信号通路
2024-08-27 iNature iNature
该研究发现CDK4/6抑制剂可以刺激STING通路,并增强STING激动剂在前列腺癌中的抗肿瘤效果。
前列腺癌患者的免疫疗法效果有限,主要原因是“冷”肿瘤微环境和新抗原的稀缺。STING-TBK1-IRF3信号轴在先天免疫中发挥重要作用,已被逐渐认识为癌症免疫治疗的潜在靶点。
2024年8月15日,中南大学金鑫独立通讯在Cancer Research在线发表题为“CDK4/6 Alters TBK1 Phosphorylation to Inhibit the STING Signaling Pathway in Prostate Cancer”的研究论文。该研究发现CDK4/6抑制剂可以刺激STING通路,并增强STING激动剂在前列腺癌中的抗肿瘤效果。
机制上,CDK4/6在前列腺癌细胞中通过磷酸化TBK1的S527位点来失活STING信号通路,这一过程与RB1无关。此外,CDK4/6介导的RB1在S249/T252位点的磷酸化还诱导了RB1与TBK1的相互作用,从而减少了TBK1在S172位点的磷酸化,进一步抑制了STING通路的激活。总的来说,这项研究表明CDK4/6通过RB1依赖性和非RB1依赖性途径抑制STING通路,提示CDK4/6抑制可能是克服前列腺癌免疫抑制的潜在策略。

前列腺癌是全球男性中最常见的癌症类型,在超过一半的国家中被认为是主要的癌症死亡原因。绝大多数前列腺癌的特征和驱动因素涉及雄激素及其受体(AR)信号的异常,因此,雄激素剥夺治疗(ADT)为基础的内分泌疗法是前列腺癌的标准治疗策略。然而,大多数接受ADT治疗的患者最终会发展为耐药,并从雄激素敏感前列腺癌(HSPC)进展为更具侵袭性的去势抵抗前列腺癌(CRPC)。
免疫系统重编程以对抗前列腺癌的策略首次受到关注是在树突状细胞疫苗sipuleucel-T获批用于无症状转移性CRPC(mCRPC)。近年来,肿瘤免疫疗法受到了广泛关注,特别是免疫检查点抑制(ICB)疗法在多种肿瘤中显示出了显著的疗效。然而,前列腺癌患者对免疫疗法的反应仍不理想。前列腺癌的异质性、“冷”肿瘤微环境以及新抗原的稀缺等因素与患者对ICB的有限反应密切相关。因此,深入阐明前列腺癌的免疫学基础,以开发能够克服冷肿瘤免疫抑制状态并激发强效抗肿瘤反应的新疗法是当前的研究重点。
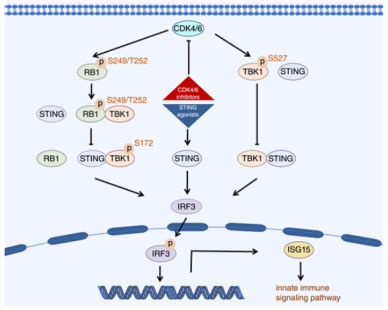
模式机理图(图片源自Cancer Research)
先天免疫系统作为对病原侵袭的初步防御机制,在诱导持久和保护性的T细胞反应中发挥了关键作用,并越来越被认为是癌症免疫治疗的潜在靶点。作为先天免疫信号通路的核心分子,干扰素基因刺激蛋白(STING)通常由于缺乏可识别的DNA而在细胞质中自我抑制。然而,染色体不稳定性是肿瘤细胞的重要特征,导致DNA异常泄漏到细胞质中。环状鸟苷酸-腺苷酸合酶(cGAS)能够检测这些游离的DNA,并催化合成第二信使2′3′-环状GMP-AMP(cGAMP),从而激活STING。激活的STING招募TANK结合激酶1(TBK1),TBK1对STING进行磷酸化。磷酸化的STING进一步招募IRF3,并促进TBK1对IRF3的磷酸化,从而促进IRF3转位到细胞核,在那里IRF3作为转录因子诱导I型干扰素和干扰素刺激基因(ISG)的表达。I型干扰素在促进树突状细胞的抗原呈递能力、刺激效应T细胞、抑制髓源抑制细胞(MDSC)扩增、减少调节性T细胞(Tregs)和肿瘤相关巨噬细胞(TAM)数量、刺激先天免疫以及将肿瘤微环境转变为有利于免疫攻击的“热”微环境中发挥关键作用。ISG15是STING通路激活的标志物,是先天免疫信号通路的重要组成部分。ISG的上调与各种疾病对ICB疗法的良好反应相关。最近的研究表明,在前列腺癌中,EZH2抑制会诱导STING信号通路,显著增加CD8+ T细胞和M1型TAM的活化,改善肿瘤环境的免疫学冷状态。此外,CRPC被认为通过cGAS-STING信号轴激活先天免疫,从而提高对药物的敏感性。因此,STING通路是免疫治疗的一个有吸引力的靶点,其激活不仅促进肿瘤微环境中的抗肿瘤免疫反应,还增加药物的敏感性。目前,几种STING激动剂,如二氨基苯并咪唑(diABZI),已在前临床研究中显示出作为广泛癌症的有前途的免疫治疗候选药物,并且相关的临床试验正在进行中。
过度增殖是癌症发展的一个标志,而周期蛋白依赖性激酶(CDK)的激活对细胞周期的进展至关重要,因此在许多恶性肿瘤中发挥着关键作用。CDK4和CDK6是G1期由周期蛋白D1/2/3激活的丝氨酸/苏氨酸激酶;这些蛋白通过磷酸化视网膜母细胞瘤(RB1)蛋白,导致E2F转录因子的释放。E2F诱导其他细胞周期蛋白的mRNA转录,如CDK2,从而促进细胞增殖。在转移性前列腺癌样本中,发现许多细胞周期相关基因发生了遗传改变,包括CDK4和CDK6的扩增。此外,研究显示RB1突变率随着前列腺癌的进展逐渐增加,从HSPC的约2%到CRPC的30%以及神经内分泌前列腺癌的90%。因此,阐明CDK4/6和RB1等蛋白在前列腺癌发展中的作用非常重要。CDK4/6的高表达与肿瘤的免疫抑制状态相关。CDK4/6抑制剂可以增加T细胞活化,从而促进抗肿瘤免疫。在前列腺癌中,周期蛋白D-CDK4复合体通过E3泛素连接酶途径使PD-L1不稳定,从而调节肿瘤免疫监视。作者之前报道了CDK4/6通过磷酸化RB1来调节前列腺癌免疫,抑制PD-L1的表达。然而,CDK4/6-RB1轴如何调节前列腺癌中的免疫反应尚未完全阐明。
多项研究表明,CDK4/6抑制剂能够诱导DNA损伤,从而激活cGAS-STING通路。同样,作者的结果揭示了CDK4/6抑制剂和STING激动剂联合治疗在消除前列腺癌细胞方面明显优于单独使用STING激动剂。然而,CDK4/6如何失活cGAS-STING通路的潜在机制仍需进一步阐明。在本研究中,作者展示了CDK4/6通过磷酸化TBK1的S527位点,破坏TBK1与STING的结合,并在前列腺癌细胞中使STING信号通路失活的机制。另一方面,CDK4/6通过磷酸化RB1的S249/T252位点,诱导RB1与TBK1的相互作用,这也破坏了TBK1与STING的结合。因此,作者确定了CDK4/6抑制剂通过去磷酸化TBK1或RB1在RB1充足和缺失的前列腺癌细胞中促进STING-TBK1通路的两种新机制。
参考消息:
https://doi.org/10.1158/0008-5472.CAN-23-3704
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#前列腺癌# #TBK1# #STING信号通路#
47