Lancet Oncol:COSMIC-312——肝癌免疫治疗之谜
2022-10-10 Biotech前瞻 Biotech前瞻
高度异质性的肝癌,对于化疗不敏感,靶向治疗时代的靶向治疗药物,也只有索拉非尼、仑伐替尼等几款药物获批。免疫治疗时代,靶免联合方案深刻改变了肝癌的治疗格局,但随着LEAP002研究、COSMIC-312
高度异质性的肝癌,对于化疗不敏感,靶向治疗时代的靶向治疗药物,也只有索拉非尼、仑伐替尼等几款药物获批。免疫治疗时代,靶免联合方案深刻改变了肝癌的治疗格局,但随着LEAP002研究、COSMIC-312研究纷纷失利,重新让人开始审视不同药物组合的靶免方案在uHCC上的治疗效果为何差异巨大。

The Lancet Oncology(IF:59.10)期刊再次提到COSMIC-312的研究,标题为:COSMIC-312:肝癌免疫之谜。
COSMIC-312是第一个旨在评估酪氨酸激酶抑制剂联合免疫检查点抑制剂双药系统全身治疗晚期肝癌一线患者的III期随机对照试验(RCT),试验组为卡博替尼(具有VEGFR2、c-Met、AXL和RET的广泛抑制特性)联合阿替利珠单抗(抗PD-L1单抗),对照组为索拉非尼。尽管mPFS优势明显,但mOS没有改善,最终以失败告终。也发让人深思,为何mOS会没有差异,且联合治疗组的总体反应率较低(432例中有47例[11%]),这表明每种药物的单药活性可能不足以保证临床的协同效应
-
该研究的一个重要启发是总生存期和无进展生存期之间的意外差异,这对无进展生存期是否可以作为临床试验的金标准-总生存获益的替代终点提出了质疑。
-
但值得一提的是,在越来越复杂的治疗环境中,进展后治疗和交叉治疗的总生存率的脆弱性增加了替代终点的价值,包括无进展生存率、进展时间和总有效率。然而,免疫治疗可以在影像学确证疾病进展后继续使用,缺乏无进展生存优势并不一定意味着患者最终不具有临床意义的总体生存益处。
-
在COSMIC-312试验中,总体生存率没有改善不太可能完全归因于患者进展后接受免疫治疗,在卡博替尼联合阿替利珠单抗组,432名患者中只有87名(20%)接受了进展后的再治疗,在索拉非尼组,217名患者中有80名(37%)接受后续治疗。缺乏二线治疗的多因素原因,需要进一步探讨,包括肝失代偿的作用。这一竞争性事件也可以部分解释无进展生存和整体生存代偿之间的不一致。
-
最后,潜在肝病的原因和对病因的充分治疗是总体生存率独立于肿瘤学特征的重要混淆因素,这促使进一步基于不同病因导致的肝癌患者治疗的研究探索。
COSMIC-312
COSMIC-312试验结果在NEJM和Lance oncology上有发表,见:一线治疗晚期肝癌哪家强?《柳叶刀肿瘤学》发布卡博替尼+阿替利珠单抗 vs 索拉非尼III期临床结果。
背 景
-
卡博替尼与免疫检查点抑制剂联合治疗实体瘤,已经显示出临床活性
-
COSMIC-312试验评估了卡博替尼联合阿替利珠单抗与索拉非尼作为晚期肝癌一线系统治疗的效果。
方法
-
COSMIC-312试验(NCT03755791)是一项开放标签、随机、III期临床试验,纳入的患者来自32个国家,178个中心,年龄≥18岁晚期肝癌患者,之前未接受系统抗肿瘤治疗和跟机制治疗或局部治疗,共计有837例。
-
纤维板层癌、肉瘤样肝细胞癌或肝细胞胆管混合癌患者排除。
-
允许肿瘤累及主要血管,包括门静脉主干。
-
患者具有可测量的肿瘤病灶(RECIST 1.1),BCLC B或C期, ECOG PS 0或1,Child-Pugh A级。
-
患者随机分配(2:1:1)为三组,分别为:卡博替尼(40mg QD PO)+
-
阿替利珠单抗(1200mg Q3W IV );索拉非尼(400mg BID PO );卡博替尼(60mg QD PO)。
-
根据疾病病因、地理区域和是否存在肝外疾病或大血管侵犯进行分层。
-
该研究采用双终点,即由盲态独立评审委员会(BIRC)先对前372名随机分配到卡博替尼联合阿替利珠单抗组或索拉非尼组ITT人群的PFS(RECIST 1.1)以及所有患者的OS。
具体研究设计如下

结果
数据截止日期(2021年3月8日),2018年12月7日至2020年8月27日期间,共计纳入837名患者,分别接受卡博替尼联合阿替利珠单抗组(n=432)、索拉非尼组(n=217)、卡博替替尼组(n=188)。无进展生存ITT患者的中位随访时间为15.8个月(IQR 14.5–17.2),ITT患者的中位随访时间为13.3个月(10.5–16.0)。
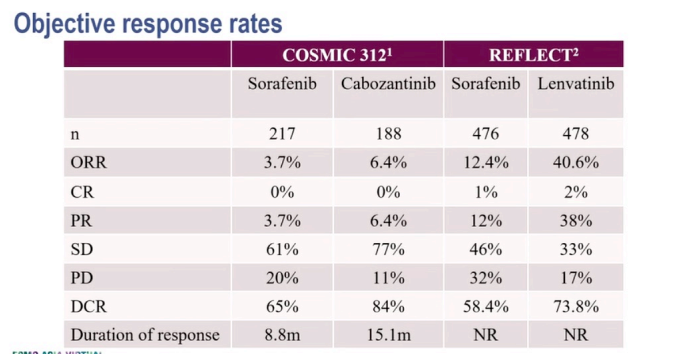
联合治疗组的mPFS为6.8个月(99%CI 5.6–8.3),而索拉非尼组为4.2个月(2.8–7.0)(HR0.63,99%CI 0.44–0.91,p=0.0012)。
联合治疗组的mOS(中期分析)为15.4个月(96%CI 13.7–17.7),而索拉非尼组为15.5个月(12.1–不可估计)(HR 0.90,96%CI 0.69–1.18;p=0.44)。

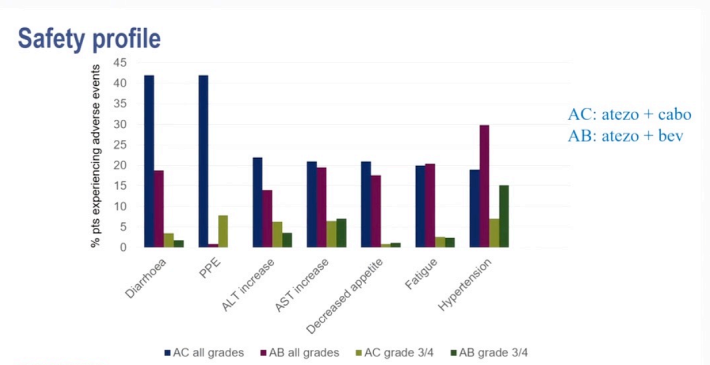
最常见的3级或4级不良事件是丙氨酸转氨酶升高(联合治疗组429例患者中38例[9%]、索拉非尼组207例患者中6例[3%]、单药卡博替尼组188例患者中12例[6%]、高血压(37例[9%]vs 17例[8%]vs23[12%]、天冬氨酸转氨酶升高(37[9%]对8[4%]对18[10%])和掌底红细胞感觉障碍(35[8%]对17[8%]对16[9%]);78人(18%)发生了严重的治疗相关不良事件联合治疗组患者中,索拉非尼组16例(8%),单药卡博坦尼组24例(13%)。联合治疗组有6(1%)名患者(脑病、肝功能衰竭、药物性肝损伤、食管静脉曲张出血、多器官功能障碍综合征和肿瘤溶解综合征)发生与治疗相关的5级事件,索拉非尼组有1(1%)名患者(一般身体健康恶化),单药卡博替尼组(胃肠道出血)1例(<1%)。
COSMIC-312研究的失利,让我们不得不去联想IMbrave150研究为何成功(阿替利珠单抗联合贝伐珠单抗)。
COSMIC-312与IMbrave150研究对比图

COSMIC-312失败研究浅析
Ib期直接跳到III期HCC头多头研究的风险
卡博替尼靶向参与肿瘤发病机制的多受体酪氨酸激酶,包括促血管生成生长因子VEGFR和MET以及TAM激酶家族(酪氨酸3,AXL,MER),有助于解除肿瘤微环境中的免疫抑制环境。

卡博替尼靶向与肿瘤免疫抑制相关通路
-
在III期临床试验(CELESTLAL),与安慰剂相比,卡博替尼在先前索拉非尼治疗后的OS和PFS所提高,因此卡博替尼被批准用于肝细胞癌患者的系统治疗。
-
卡博替尼联合免疫检查点抑制剂在几种实体瘤中显示出良好的临床活性,包括III期临床研究CheckMate 9ER,与舒尼替尼相比,PFS和OS有所提高,作为肾癌的一线治疗。
-
卡博替尼联合阿替利珠单抗的1b期试验显示了对几种不同实体瘤的临床活性,并确定了进一步开发的推荐联合剂量。
基于以上的证据链,卡博替尼开启了头对头对比索拉菲尼的三臂试验-COSMIC-312。足见信心很大,卡博替尼联合阿替利珠单抗,对比索拉菲尼,2打1还干不过吗?但盲目的自信,导致了最终OS的未获益。主要的原因,总结如下几点:
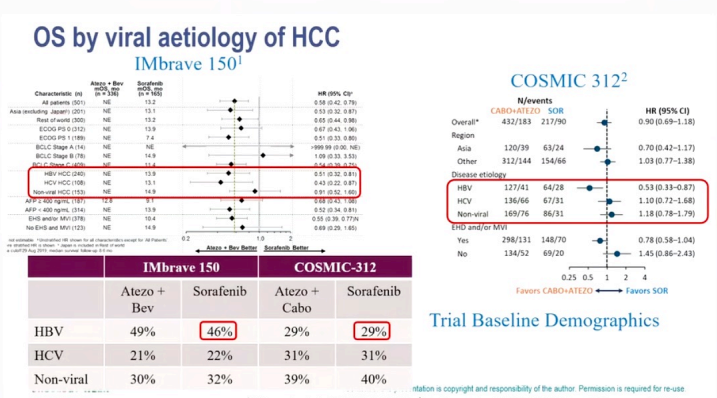
一、HBV感染导致的HCC更免疫获益
与试验队列设计相比,我更关注的是其分层因素里有涉及病因,而我对于不同病因导致的HCC患者的免疫获益情况的不同,之前有过多篇文章的阐述。
Cancers:控制良好的病毒血症可预测索拉非尼治疗的慢性病毒性肝炎患者的肝细胞癌预后
Front Immunol:隐匿性乙型肝炎病毒感染者乙肝疫苗免疫应答的调查
Front Immunol:HBV感染肝癌患者接受PD-1抑制剂联合治疗时HBV DNA和乙肝表面抗原水平与肿瘤疗效、肝功能和免疫学指标的相关性
我粗浅的认知中是为何全球的研究很多失败的,但在亚洲人群,尤其是中国亚组的数据,要明显高于其他亚组的数据呢?中国的HCC患者主要是乙肝病毒感染导致,在我国乙型病毒性肝炎相关肝癌占总病例数的75%~90%,在乙型病毒性肝炎相关肝癌的疾病进程中存在免疫失调机制,其中PD-1和CTLA-4等免疫抑制因子过表达引起T细胞失活,参与了病毒感染慢性化,肝炎自限性发展及肝癌发生、发展等诸多过程。可能更会从免疫治疗中获益。

那这种情况,在COSMIC-312试验中也是如此。虽然整体OS数据是失败的,但在ITT人群的HBV亚组(n=191),卡博替尼+阿替利珠单抗组和索拉非尼单药组的mOS分别为18.2个月和14.9个月(HR 0.53;95%CI:0.33~0.87);在HCV亚组(n=203),两组的中位OS分别为13.6个月和14.0个月(HR 1.10;95%CI:0.72~1.68);在非病毒组(n=255),两组的中位OS分别为15.2个月和未达到(HR 1.18:95%CI:0.78~1.79)。也验证了HBV感染导致的HCC更能从免疫联合治疗中获益。
二、索拉菲尼单药组后续治疗,免疫占比高于联合组
-
对于停止研究治疗的患者,联合治疗组432名患者中有87名(20%)使用了随后的全身抗肿瘤治疗,索拉非尼组217名患者中有80名(37%)使用了后续的全身抗肿瘤治疗,单药卡博坦尼组188名患者中有54名(29%)使用了后续的全身抗肿瘤治疗。
-
联合治疗组有17(4%)名患者接受了免疫检查点抑制剂,而索拉非尼组有36(17%)名患者接受了免疫检查点抑制剂,单药卡博坦尼组有24(13%)名患者接受了免疫检查点抑制剂
三、免疫联合抗血管靶向药无法OS获益?
LEAP-007肺癌试验失败的启示(肝癌篇)一文有说到过,免疫联合靶向在初期的缩瘤效果是非常明显的,但在长期生存获益上不一定能够取得。这就导致目前正在研究中的免疫联合抗血管生成药物的尴尬处境。COSMIC-312试验也是如此。

最后,总结下目前主要已经上市的小分子抗血管生成药物。
随着免疫药物在索拉非尼组序贯治疗的应用,以及不同亚群患者治疗获益的不同。肝癌的临床试验设计,逐步到达比拼产品真正实力的阶段。但不同的试验设计之间,不能直接对比,且目前也缺乏机制详细的探讨研究,这种情况也造成后来者很难在异质性强的肝癌领域开展大型III期研究的信心,但毫无疑问的是,免疫治疗无疑深刻改变了肝癌的治疗格局,未来,期望能够有更多获益数据的公布。
参考文献
1.https://doi.org/10.1016/S1470-2045(22)00497-1
2.Kelley RK, Yau T, Cheng A-L, et al. doi:10.1016/j.annonc.2021.10.008
3CellMol Immunol,2016,13(3):267-276. DOI:10.1038/cmi.2016.3.
4.IntJMol Sci, 2017, 18(7):1517. DOI:10.3390/ijms18071517.
5.https://doi.org/10.1016/S1470-2045(22)00326-6.
6.Kelley, Oliver, Hazra et al.Future Oncol. 2020 Jul;16(21):1525-1536.
作者:Biotech前瞻
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言