Leukemia:上海交大蒙国宇团队揭示癌蛋白DUX4/IGH在白血病中的发病机制
2018-03-22 BioArt BioArt
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)为起源于淋巴干祖细胞克隆增殖的血液系统恶性疾病,全美在20岁前人群发病率约为30例/百万人,且高发率出现在3~5岁,是儿童中最常见的白血病类型。儿童ALL依据细胞表面与胞质表达的髓系标记可分为B淋巴干祖细胞克隆(占比约85%)与T淋巴干祖细胞克隆(占比约15%),因此,急性B淋巴细胞白血病的临床诊断与治愈引起了研
近日,来自上海交通大学的蒙国宇团队与陈竺、陈赛娟团队合作,针对急性B淋巴细胞白血病(B-ALL)致病基因DUX4/IGH展开了系列研究,阐明了DUX4/IGH如何驱动B-ALL发病的具体分子和结构生物学基础(图1)。相关成果以“”为题发表于血液学领域知名杂志Leukemia。
位于4号染色体端粒上的DUX4基因序列插入到14号染色体上的免疫球蛋白重链(IGH)内部,形成DUX4/IGH融合基因并异常高表达,其存在是B-ALL分类的一个重要新型标志物。DUX4蛋白是一个双同源盒转录因子,包含氮端两个识别DNA的同源结构域HD1和HD2,以及碳端招募相关转录因子的CTD结构域。在正常生理状态下,DUX4的表达沉默;DUX4的表达异常则会引起面肩肱型肌营养不良症(FSHD)。此外,DUX4表达的失调也与转录因子ERG的表达密切相关。ERG基因在造血生成与急性淋巴细胞白血病中都发挥了重要作用。
在本研究中,蒙国宇团队通过分析ChIp-seq数据并挖掘出DUX4与下游靶基因结合的核心DNA序列。该团队大胆假设,DUX4/IGH癌蛋白与靶点基因结合可能是白血病发病的重要节点事件,并通过结构生物学为重要切入点,探究DUX4/IGH引发白血病的致病机理。
蒙国宇团队首先通过晶体学手段解析出2种不同的DUX4结构,即不与DNA底物结合的Apo-DUX4和与DNA结合的DUX4-DNA复合物结构。然后,通过结构比对确认DUX4/IGH与靶基因(TAATCTAAT)结合的方式和相互作用的空间位点。在结构生物学的基础上,通过定点突变,在分子、细胞和动物水平上分别进行功能验证(“小心的求证”)。研究结果一致指出,DUX4-DNA的结合对白血病发病有非常重要的意义:破坏DUX4与DNA的结合将严重抑制DUX4/IGH对靶基因的激活,进而破坏DUX4/IGH对B细胞的分化抑制、增殖效应等癌蛋白功能。
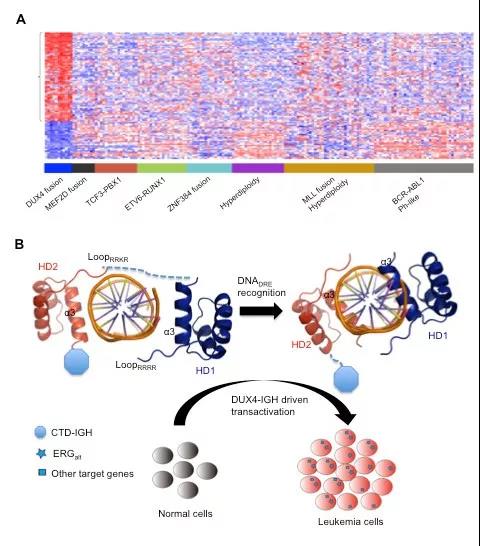
这项研究在一定程度上阐释了DUX4/IGH在B-ALL中的发病机制。改变或抑制其与DNA的相互作用可能会抑制白血病的发生,从而为治疗该类白血病提供新的靶点,同时也为白血病的治疗提供新思路。蒙国宇研究员和陈赛娟研究员为共同通讯作者,博士研究生董雪、博士后张伟娜、博士后武海燕和副研究员黄金艳为共同第一作者。
原始出处:
Xue Dong, Weina Zhang, Haiyan Wu, et al.Structural basis of DUX4/IGH-driven transactivation.15 March 2018.Leukemia.doi:10.1038/s41375-018-0093-1
作者:BioArt
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#蒙国宇团队#
63
#DUX4/IGH#
65
#上海交大#
54
学习
87
阅
108