【综述】水通道蛋白4在缺血性卒中后的作用及调控机制研究进展
2024-11-17 中国脑血管病杂志 中国脑血管病杂志
者综述了AQP4的结构、功能及其在缺血性卒中后的表达变化和作用,特别是AQP4在缺血性卒中后脑水肿形成、血-脑屏障通透性增加以及神经炎症中的最新研究进展,以期深化对缺血性卒中发生发展机制的理解,
摘要:水通道蛋白4(AQP4)为大脑中最为丰富的水通道蛋白成员,其功能活动与缺血性卒中后的病理过程紧密相关。缺血性卒中后,机体通过转录过程以及翻译后修饰等多种方式影响AQP4蛋白的表达水平、磷酸化状态以及其在细胞膜上的极性分布。作者综述了AQP4的基本结构、生理功能及其在缺血性卒中后的动态表达变化与作用机理,具体讨论了AQP4在缺血性卒中后脑组织水肿形成、血-脑屏障通透性增加和神经炎症加剧中作用及调控机制的研究进展,为探索针对缺血性卒中的有效治疗策略提供新的视角。
缺血性卒中作为一种严重的神经系统疾病,给全球健康和社会带来了巨大的负担。深入了解缺血性卒中的发生和发展机制,并采取有效的预防和治疗措施,对于改善患者的预后至关重要。近年来,水通道蛋白4(aquaporin4,AQP4)在缺血性卒中后脑水肿形成中的关键作用受到了广泛关注。AQP4是脑脊液与细胞间液水分交换的关键介质,在维持脑内液体平衡中发挥着至关重要的作用,其可参与调控脑水肿、影响血-脑屏障功能以及介导神经炎症。笔者综述了AQP4的结构、功能及其在缺血性卒中后的表达变化和作用,特别是AQP4在缺血性卒中后脑水肿形成、血-脑屏障通透性增加以及神经炎症中的最新研究进展,以期深化对缺血性卒中发生发展机制的理解,也为缺血性卒中疾病的治疗和康复提供新的思路。
1 AQP4的结构和生理功能
水通道蛋白是一类高度选择性的膜通道蛋白家族,负责转运水分子,其相对分子质量约为30kDa。AQP4作为脑内最丰富的水通道蛋白,表现为四聚体结构,每个单体包含6个跨膜α螺旋和5个环式结构。AQP4有2个亚型:M1亚型和M23亚型,可根据胞内N末端的氨基酸残基序列区分。M1亚型倾向于形成自由移动的四聚体,而M23亚型则能在星形胶质细胞胞膜上进一步组装成为正交排列颗粒的超分子结构(图1)。正交排列颗粒的尺寸和形状受M23亚型与M1亚型比例的调控,可增强AQP4的水转运效能。AQP4在大脑中的分布具有高度特异性,主要分布在星形胶质细胞、神经胶质界膜和室管膜等关键部位,特别是在环绕毛细血管的星形胶质细胞终足最为密集(图2)。这种极性分布也称为极化,即AQP4在血管周围星形胶质细胞足突膜而非胞体上的富集,去极化则为AQP4定位从星形胶质足突膜上转移至细胞膜上,对于确保脑内水分平衡及促进水分子在胶质细胞、间质液、血液与脑脊液间的有效转运至关重要。此外,AQP4还参与多种生物学过程,包括神经炎症反应、突触可塑性调节以及星形胶质细胞的迁移活动等。
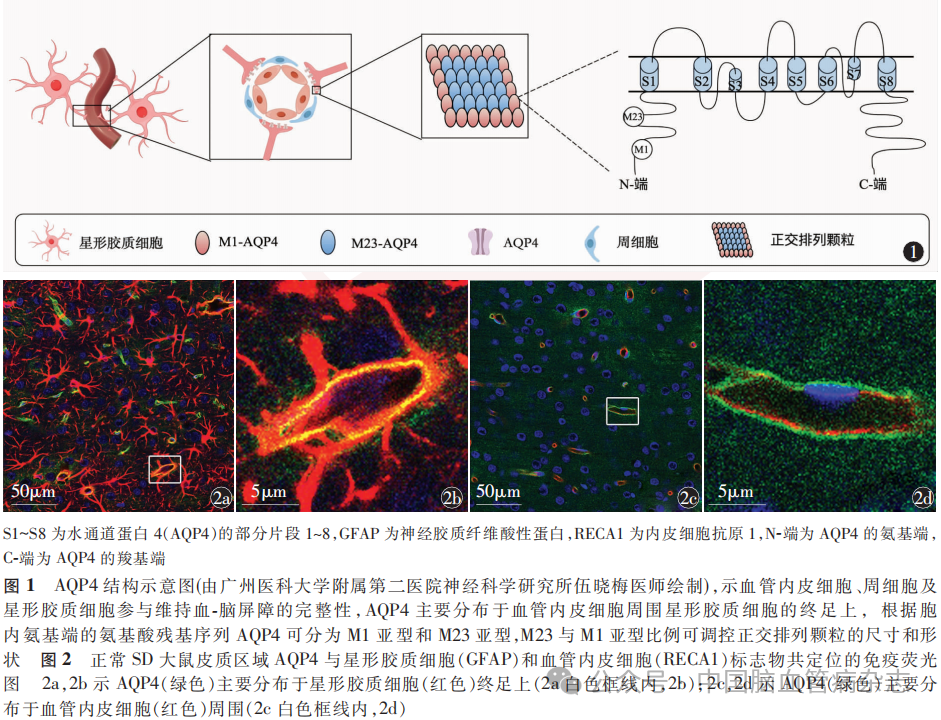
2 缺血性卒中后AQP4在中枢神经系统中的表达
动物实验研究表明,AQP4的表达主要于脑梗死中心及周围区域发生上调。在雄性Wistar大鼠大脑中动脉闭塞(middl ecerebral artery occlusion, MCAO)再灌注模型中,通过实时定量聚合酶链反应检测AQP4的信使核糖核酸(messenger ribonucleic acid, mRNA)水平,结果显示,大鼠MCAO90min再灌注7d后皮质梗死核心区域mRNA水平较假手术组上调约2倍(P<0.05)。在雄性SD大鼠MCAO 120 min再灌注24h后,与假手术组比,MCAO大鼠梗死侧皮质梗死周围区域AQP4的mRNA水平增高了约2倍(P<0.05)。在Wistar大鼠永久性MCAO 80 min后,免疫印迹检测结果显示,与梗死对侧相比,永久性MCAO大鼠梗死侧皮质顶叶梗死区域AQP4的蛋白水平增加约3倍(P<0.05)。
缺血性卒中不仅影响AQP4蛋白的表达水平,还可导致AQP4不能正常定位于血管周围的星形胶质细胞的足突膜上。研究表明,野生型小鼠AQP4免疫荧光染色主要分布在血管内皮细胞周围星形胶质细胞终足上,且呈长条状血管形态,而C57BL/6小鼠MCAO 35min再灌注72h后其梗死同侧纹状体区域AQP4的染色模式主要呈点状分布,血管周围染色缺失。在C57BL/6小鼠永久性MCAO模型中,经过150 min的缺血处理后免疫荧光结果显示,与假手术组相比,永久性MCAO小鼠梗死侧分布于皮质和纹状体的血管周围的AQP4减少(均P<0.05)。上述动物实验研究结果表明,缺血性卒中后缺血病灶中心区域及周围区域AQP4的表达上调,但未能正常分布于血管周围星形胶质细胞的足突膜上,即极性分布下降。
3 AQP4在缺血性卒中后的作用及调控机制
3.1 AQP4对缺血性卒中后脑水肿的影响
缺血性卒中发生后,根据血-脑屏障是否破坏可将脑水肿分为细胞毒性水肿和血管源性水肿,AQP4可通过调控脑内水分的转运,对这两种类型的水肿产生影响。一方面,正常情况下AQP4在星形胶质细胞终足的表达可增强水分子跨细胞膜的转运效率,特别是在面向毛细血管的位置。有研究将AQP4中第25位丙氨酸→谷氨酰胺点突变(A25Q)转基因敲入雄性C57BL/6小鼠构建AQP4-A25Q突变模型,免疫荧光检测结果显示,与野生型小鼠相比,AQP4-A25Q小鼠星形胶质细胞的非血管周围部分显示出更强的AQP4免疫反应性;随后对AQP4-A25Q小鼠进行MCAO 2 h再灌注24 h处理,透射电镜检查显示,AQP4-A25Q小鼠较野生型小鼠星形胶质细胞足突面积增加约10倍(P=0.0086);并且使用干湿重法对脑含水量进行评估后显示,与MCAO再灌注后的野生型小鼠相比,MCAO后AQP4-A25Q突变小鼠的脑水含量降低(P<0.05)。在MCAO 90 min再灌注24 h的SD大鼠模型中,MCAO大鼠梗死侧AQP4表达量是假手术组的3倍(P<0.01),此时MCAO大鼠脑水肿加重但通过免疫组织化学染色检测内皮屏障抗原(血-脑屏障完整的标志物)显示血-脑屏障完整,提示大鼠处于脑水肿早期细胞毒性水肿阶段,表明AQP4表达上调参与缺血后早期细胞毒性脑水肿的形成,提示AQP4表达量升高在脑水肿早期阶段可能是有害的。另一方面,在Wistar大鼠右侧基底节区注射小干扰RNA(small interfering RNA, siRNA) -AQP4脂质体下调AQP4的表达,随后对大鼠进行MCAO 2 h处理,通过电镜可以观察到大鼠血-脑屏障完整,提示其处于细胞毒性水肿阶段,此时使用溶媒处理的MCAO2h对照组大鼠胶质细胞明显固缩和肿胀变形,而siRNA-AQP4组MCAO 2h大鼠梗死区域细胞水肿较溶媒处理的MCAO大鼠减轻;但在MCAO 6h时,电镜下MCAO 6h组大鼠梗死区域的血-脑屏障破坏,提示其处于血管源性水肿阶段,此时MCAO 6h大鼠较MCAO 2h梗死区域水肿进一步加重,但siRNA-AQP4组MCAO 6h后大鼠梗死区域水肿较溶媒处理的MCAO 6h对照组无明显改善,表明AQP4在细胞毒性水肿阶段起到有害作用,但是在血管源性水肿阶段作用有限。
此外,AQP4作为类淋巴系统的组成部分,对于脑内代谢废物的清除和水稳态的维持至关重要。研究表明,C57BL/6小鼠MCAO 45 min后,与梗死对侧比较,其梗死侧血管周围区域AQP4的表达显著下降(P<0.05),研究者向MCAO后小鼠枕大池注射6μl钆-二乙烯三胺五乙酸,采用高分辨率MRT1加权成像动态(注射钆-二乙烯三胺五乙酸后0.5、2.0、4.0、6.0h)评估小鼠的类淋巴系统功能,结果显示,MCAO 45 min再灌注2d小鼠脑脊液引流速度于注射钆-二乙烯三胺五乙酸后4 h达高峰,而假手术组于注射钆-二乙烯三胺五乙酸后2h达高峰,提示MCAO后小鼠类淋巴系统流入功能下降;通过脑半球水肿容积值(采用MRT2加权成像检测的高信号区域)衡量脑水肿情况,结果显示,MCAO 45 min再灌注2d小鼠脑半球水肿容积值较假手术组升高约30倍(P<0.05),这表明缺血性卒中后AQP4极性定位下降,可能导致类淋巴系统功能障碍进而加重脑水肿状态。上述研究表明,虽然AQP4在缺血性卒中后表达升高,但是若其未能正常定位于星形胶质细胞足突膜即去极化,亦可直接影响脑内水分的平衡与代谢废物的排出。此外,AQP4在缺血性卒中后细胞毒性水肿阶段发挥有害作用,但其在血管源性水肿阶段所发挥的作用有限,仍需要进一步探究AQP4在缺血性卒中后脑水肿不同阶段的作用机制,以进一步明确AQP4在缺血性卒中后脑水肿的发展进程中所发挥的作用。
3.2 AQP4对缺血性卒中后血-脑屏障通透性的影响
血-脑屏障由血管内皮细胞及连接内皮细胞的紧密连接蛋白组成,并由星形胶质细胞、周细胞和细胞外基质所支持。研究显示,AQP4通过与星形胶质细胞终足上的α-肌营养蛋白相互作用,不仅可调控水分的转运,还间接参与血-脑屏障的结构稳定和功能维持。一项关于AQP4对于血-脑屏障作用的研究构建了AQP4敲除小鼠模型,随后通过透射电镜观察到AQP4敲除小鼠纹状体中紧密连接异常(通过连接质膜的外部小叶的分离鉴定);而在野生型小鼠纹状体中检测到广泛的紧密连接,质膜外部小叶完全融合,表明AQP4敲除后血-脑屏障完整性受损;此外,通过向小鼠颈静脉注射血管通透性标志物辣根过氧化物酶(0.3mg/kg), 10min后取脑组织,通过光学显微镜检测中脑区域辣根过氧化物酶的分布情况以检测血-脑屏障通透性,结果显示,AQP4敲除小鼠纹状体中出现大量血管周围辣根过氧化物酶渗漏区域,而野生型小鼠的辣根过氧化物酶仅位于纹状体血管内,表明AQP4敲除小鼠血-脑屏障通透性增加。Zhu等的研究显示,缺血性卒中后AQP4极性定位改变可能影响血-脑屏障的完整性,该研究采用SD大鼠构建MCAO 1.5h再灌注7d模型,使用免疫印迹检测梗死侧皮质细胞膜及细胞质AQP4的蛋白表达(以AQP4在细胞膜的表达增加为极性定位增加),结果显示,与假手术组相比,MCAO大鼠AQP4在细胞膜的表达下调约10%,而在MCAO后通过跑步机训练(无坡度,10m/min, 30min/d)可使梗死侧中脑的AQP4在细胞膜的表达增加;并且采用伊文思蓝检测血-脑屏障的通透性显示,与未进行跑步机训练的MCAO大鼠比较,跑步机训练后的MCAO大鼠伊文思蓝渗漏量增加约20%(均P<0.05);而在电镜下观察血-脑屏障的完整性显示,与未进行跑步机训练的MCAO大鼠比较,跑步机训练后的MCAO大鼠基底膜更规则,骨折程度明显改善,电子密度均匀,血-脑屏障结构改善。然而,使用SD大鼠构建MCAO2h再灌注24h模型,在MCAO手术后腹腔注射大黄素(15mg/kg)2次(于MCAO后8、12h注射)以抑制AQP4的表达,再灌注24h时的免疫印迹结果显示,MCAO后腹腔注射大黄素大鼠的AQP4相对表达量较MCAO后溶媒对照组下调约50%;且伊文思蓝检测结果显示,MCAO后腹腔注射大黄素大鼠的伊文思蓝渗漏量较溶媒组减少50%以上(P<0.01),提示血-脑屏障通透性降低。以上研究表明,虽然AQP4参与维持血-脑屏障的完整性,但缺血性卒中后AQP4的过度上调或者极性定位下降会导致血-脑屏障损坏,加重神经功能损伤。
3.3 AQP4在缺血性卒中后神经炎症的作用
近年来,AQP4与神经炎症之间复杂的相互作用逐渐成为研究热点,尤其是在缺血性卒中领域。神经炎症作为缺血性卒中后脑损伤的关键反应,涉及星形胶质细胞和小胶质细胞的激活,以及随之产生的细胞因子和趋化因子的释放,AQP4在这一过程中的角色日益受到重视。缺血性卒中后,AQP4未能极性分布于血管周围星形胶质细胞足突膜上可引起淋巴功能障碍,导致淀粉样蛋白和炎症因子等代谢废物的积累,最终加剧脑损伤。已有研究表明,在采用C57BL/6小鼠构建的MCAO 90min再灌注48h模型中,在闭塞成功5min后腹腔注射AQP4抑制剂2-烟酰胺-1,3,4-噻二唑(2-nicotinamide - 1,3,4 - thiadiazole, TGN020; 200mg/kg)可以抑制AQP4的去极化,随后将10μl小分子示踪剂注射进枕大池以及将2μl大分子示踪剂注射进小鼠纹状体区域循环30 min后检测其荧光强度,以评估类淋巴系统的的流入以及流出功能,结果显示,MCAO小鼠小分子示踪剂荧光进入脑区较假手术组减少,提示类淋巴系统流入功能受损,而大分子示踪剂残留在纹状体的荧光较假手术组增多,提示类淋巴系统流出功能受损,但是在MCAO后使用TGN-020时小鼠的类淋巴系统功能较MCAO后使用溶媒组小鼠改善(P<0.01),并且与单纯MCAO小鼠比较,MCAO后使用TGN-020小鼠的肿瘤坏死因子α、白介素1β(IL-1β)表达量均下降约50%(均P<0.01).在体外模型中,对星形胶质细胞转染慢病毒可使AQP4过表达3倍以上(P<0.01),随后对过表达AQP4的星形胶质细胞进行氧-葡萄糖剥夺/复氧(oxygen glucose deprivation/re-oxygenation,OGD/R)处理,免疫印迹检测显示,与AQP4表达正常且OGD/R后的星形胶质细胞相比,AQP4过表达且OGD/R后星形胶质细胞的多种炎性细胞因子包括肿瘤坏死因子α、IL-1β和IL-6的蛋白水平均升高(均P<0.05)。因此,缺血性卒中后AQP4可能通过影响类淋巴系统功能导致炎症因子清除减少,参与了缺血性卒中后神经炎症的发展进程。
3.4 AQP4在缺血性卒中后的调控机制
在缺血性卒中后,AQP4的调控机制呈现出高度的复杂性和多样性,涉及多个层面的精细调控。已有研究表明,采用C57BL/6小鼠构建MCAO 1h再灌注24h模型后,微小核糖核酸(micro ribonucleic acid, miR)29a较假手术组表达减少,AQP4的表达上调,从而加剧缺血后脑损伤,在体外星形胶质细胞中共转染天然或突变片段的AQP4 mRNA3′-非翻译区(untranslated regions, UTR)和带有萤光素酶的miR-29a模拟物,使用荧光测定仪检测萤光素酶的荧光强度,结果显示,与共转染突变3′-UTR片段相比,用miR-29a模拟物和天然3′-UTR片段共转染的星形胶质细胞的荧光素酶荧光强度降低(P<0.05),表明AQP4可能是miR-29a的直接靶点。有研究显示,miR-320a可直接抑制AQP4的表达,Sepramaniam等将前体miR-320a或抗miR-320a模拟物与AQP4共转染至海拉细胞并检测荧光素酶的活性,结果显示,与使用抗miR-320a模拟物相比,使用前体miR-320a模拟物时海拉细胞的荧光素酶表达下降(P<0.05);随后采用SD大鼠构建MCAO1h再灌注24 h模型,在MCAO手术后立即脑室内注射前体miR-320a,结果显示,MCAO后转染前体miR-320a大鼠的AQP4 mRNA水平较转染抗miR-320a模拟物大鼠表达上调约3.5倍(P<0.01),梗死体积减少约50%(P<0.01)。
AQP4的功能除了受其表达水平的调控,AQP4本身磷酸化水平的状态对其表达调控也甚为关键。Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ和蛋白激酶C,可分别通过促进AQP4的丝氨酸111位点磷酸化和抑制S180位点的磷酸化,使水分子更容易进入星形胶质细胞中。此外有研究表明,缺血性卒中后基质金属蛋白酶9(MMP-9)升高可切割β-肌营养不良聚糖(β-dystroglycan,β-DG)43成为β-DG30从而抑制AQP4的极性分布。这一点在采用C57BL/6小鼠构建的永久性MCAO24h模型中得到验证,该研究在MCAO术后立即腹腔注射MMP-9选择性抑制剂卡托普利(4mg/kg),随后提取小鼠大脑梗死皮质组织与重组MMP-9(3.2mg/L)进行体外蛋白质切割实验,通过免疫印迹实验评估β-DG43的切割产物,结果显示,与未加入重组MMP-9的MCAO小鼠相比,加入重组MMP-9的MCAO小鼠成熟β-DG43水平下降(P<0.05),而使用卡托普利抑制重组MMP-9作用后,其成熟β-DG43蛋白水平上调约50%(P<0.01),而裂解β-DG30的蛋白水平下调约25%(P<0.05),提示MMP-9可切割成熟β-DG43成裂解的β-DG30。为了评估β-DG43被切割后是否改变了AQP4的分布,该研究对永久性MCAO小鼠进行AQP4和β-DG免疫荧光染色,结果显示,假手术组AQP4和β-DG共定位于血管周围区域,而永久性MCAO后小鼠的AQP4在皮质梗死周围区域的血管周围区域失去其极化定位,且β-DG的荧光强度也同步降低,但是使用卡托普利可抑制血管周围区域的AQP4和β-DG的丢失。综上所述,缺血性卒中通过miRNA介导的转录后调控、蛋白激酶介导的磷酸化修饰,以及MMP-9影响AQP4的极性定位,调控AQP4的表达和分布。
4 总结
综上所述,AQP4作为脑内水分调节的关键分子,在缺血性卒中后发挥着重要作用。AQP4不仅参与缺血性卒中后脑水肿的形成和调控血-脑屏障的通透性,还与神经炎症紧密相关。AQP4功能的复杂性,要求我们更加精准地把握特定的AQP4亚型、细胞类型或特定的病理阶段在缺血性卒中后不同时期的作用,以期AQP4成为缺血性卒中后的治疗靶点时,既能有效缓解缺血性卒中引起的水肿和炎症反应,又不破坏正常的脑内水分调节机制,避免对脑组织造成额外伤害。此外,可探索AQP4与其他分子通路的交互作用,寻找协同治疗的策略,以达到更全面的神经保护效果。
作者:中国脑血管病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










AQP4是脑脊液与细胞间液水分交换的关键介质!
50
#缺血性卒中# #水通道蛋白4#
59