HPV相关性口咽癌及免疫治疗研究进展
2024-10-03 小药说药 小药说药
介绍口咽鳞状细胞癌中 HPV+OPSCC 的流行病学、分子机制、临床管理及免疫疗法进展,强调其发病率上升及免疫治疗前景。
前言
口咽鳞状细胞癌(OPSCC)包括扁桃体癌、舌根癌、软腭癌和悬雍垂癌。与其他头颈部鳞状细胞癌(HNSCC)一样,OPSCC历来与饮酒和吸烟有关。在过去20年中,大多数发达国家吸烟率的降低导致了HNSCC发病率的下降;然而,致癌的人乳头瘤病毒(HPV)感染已成为另一个重要的风险因素,它导致了OPSCC发病率的增加。目前,人乳头瘤病毒(HPV)阳性OPSCC已成为发达国家癌症发病率增长最快的癌种之一。
最新版本的美国癌症联合委员会(AJCC)分期系统将HPV阳性和HPV阴性的OPSCs定义为单独的实体,具有不同的分子特征、肿瘤特征和临床结果。由于HPV+OPSCs的独特生物学特性,免疫治疗已成为当前一个特别受关注的领域。下面我们一起回顾一下HPV+OPSCC的流行病学、分子机制、临床管理以及特别在免疫治疗领域的重要进展。
HPV+OPSCC的流行病学
在所有癌症中,OPSCC是发达国家发病率上升最快的癌症之一。在英国、美国、整个欧洲、新西兰和亚洲的部分地区,这种疾病的发病率不断上升。在英国和美国,男性口咽癌的发病率都超过了女性宫颈癌的发病率。
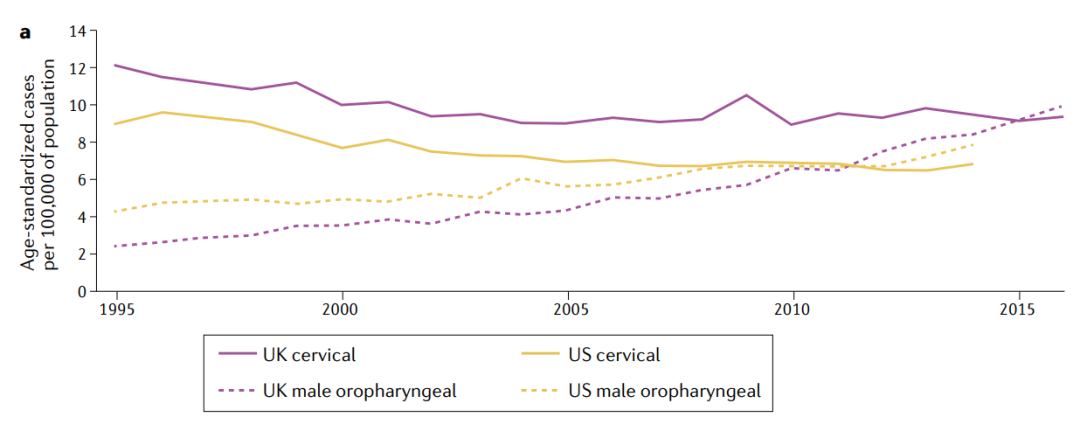
在过去20年中,HPV+和HPV–OPSCC的发病率都有所增加,有证据表明前者的增长速度更快。在丹麦,从2000年到2017年,HPV+OPSCC的发病率增加了三倍,而HPV-的发病率增加了两倍。相比之下,在台湾观察到HPV+HNSCC,尤其是扁桃体鳞状细胞癌(SCC)的增长更快。在意大利,HPV+OPSCC的发病率从2000-2006年的16.7%增加到2013-2018年的46.1%。
此外,HPV+OPSCC的患病率已开始向老年男性转移。在一项研究中,诊断年龄中位数在1998年至2013年期间从53岁增加到58岁,而另一项研究报告了类似的增加,在2002年至2017年期间从52岁增加到59岁。尽管负担正在向老年人转移,但大多数病例仍发生在年龄在65岁以下人群中。
HPV+OPSCC的分子机制
HPV是无包膜病毒,其环状双链DNA基因组约为8kbp。已经确定了200多种HPV类型,所有这些类型都会在皮肤或粘膜上皮中感染并完成其生产生命周期。其中,世卫组织目前将14种粘膜HPV类型(HPV-16、18、31、33、35、39、45、51、52、56、58、59、66和68)归类为“高危型”(hrHPV),因为有明确的实验和流行病学证据表明它们与癌症病因有关,HPV-16至少占所有HPV+OPSCCs的85%。
HPV+致癌主要由两个病毒早期基因(E6和E7,被认为是HPV癌基因)驱动,其生理功能是触发上皮基底层的细胞周期进入,从而允许病毒基因组复制。E6和E7的表达增加通常与hrHPVDNA整合到宿主基因组中有关。
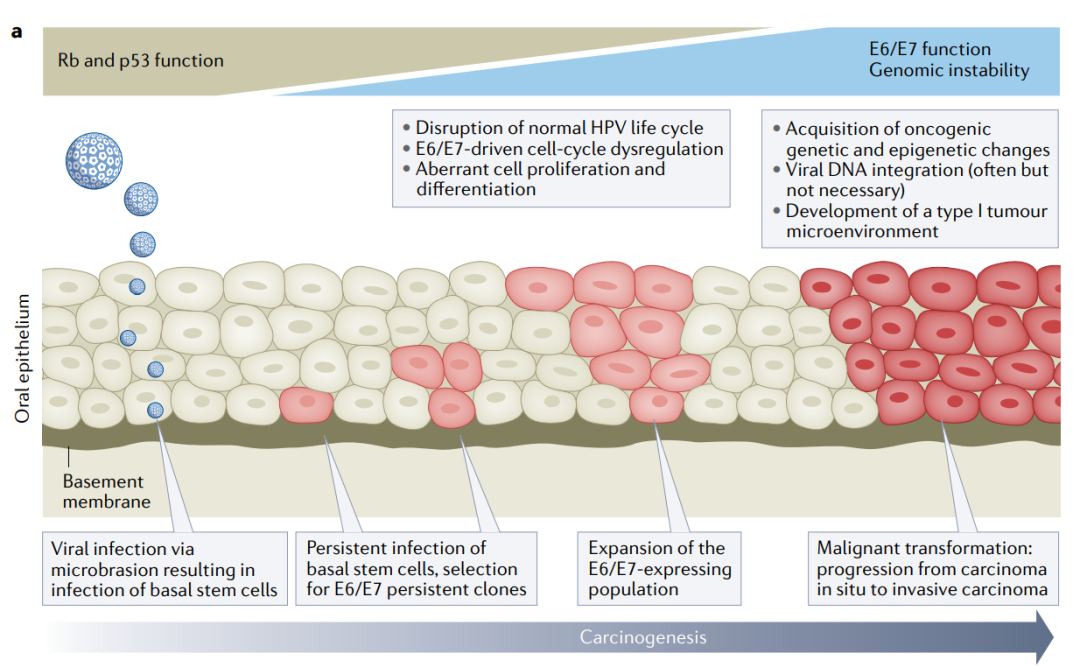
许多研究已经深入了解E6和E7诱导宿主细胞进入细胞周期和DNA复制的分子机制。这些效应,再加上宿主基因组的改变,可以导致宿主细胞的恶性转化。E6和E7最具特征的两种致癌活性分别涉及p53和Rb的降解增加。去除这些关键的肿瘤抑制蛋白会导致细胞周期检查点激活丧失,从而对DNA损伤作出反应,并导致DNA复制的不可控,这两者共同导致基因组不稳定和抗凋亡的发生。
HPV+OPSCC的临床管理
OPSCC最常见的表现为颈部肿块或喉咙痛,但也可能表现为吞咽困难、可见肿块、癔球症、吞咽困难或耳痛147。大多数患者表现为原发性小肿瘤(T1或T2)和淋巴结转移。此外,OPSCC的临床表现很容易与其他常见的良性疾病相混淆,如咽喉反流或咽球;因此,理想情况下,无症状颈部肿块应使用确认性超声检查和细针活检样本进行评估。
为了准确区分HPV阳性和阴性,需要进行强有力的HPV检测。p16的免疫组织化学(IHC)染色和高危HPV的原位杂交(ISH)的组合已证明敏感性(97%)和特异性(94%)都达到了可接受的水平,并且可以使用福尔马林固定的石蜡包埋组织进行检测。
OPSCC患者的治疗通常包括手术切除、初级放疗或放化疗。历史上,手术切除涉及开放手术,然而,由于对美容和/或功能性疾病的担忧,对于早期疾病患者来说,这在很大程度上已被微创技术所取代。如果手术在技术上不可行,例如由于原发肿瘤直径大(T3或以上)、经口途径不良或晚期双侧淋巴结疾病,也可广泛使用原发放疗和化疗。目前的护理标准为66-70Gy放疗同时进行铂类化疗,通常以顺铂为基础。
HPV+OPSCC的免疫疗法
在HPV+恶性肿瘤患者中,促进对病毒抗原(尤其是源自E6和E7的抗原)或增强已有的抗肿瘤免疫反应是一个诱人且长期寻求的免疫治疗前景。在过去的20年里发展了多种多样的HPV+癌症免疫治疗方法。然而,迄今为止,只有抗PD-1/PD-L1抗体被批准用于临床。
2016年,根据三期临床试验CheckMate-141和KEYNOTE-040的数据,FDA首次批准将抗PD-1抗体nivolumab和pembrolizumab用于转移性铂类难治性HNSCC(无论HPV状态如何)患者。根据三期KEYNOTE-048试验的数据,2019年pembrolizumab也被批准作为一线单一疗法用于PD-L1+转移性或不可切除的HNSCC患者。这些试验都包括同时患有HPV+和HPV-的患者,其中三项研究表明,HPV+疾病患者的客观应答率(ORR)增加,OS改善,其中一项研究表明,在PD-L1阻断的情况下,HPV状态和预后之间的关系更强,而另外一项发现HPV状态和预后之间没有关联。因此,这强调了对这一重要问题进行进一步研究的必要性。
在新辅助环境下,一项nivolumab联合立体定向全身放疗(SBRT)的Ib期试验(NCT03247712)在21例局部晚期HNSCC患者队列中产生了较高的病理完全应答(pCR)率(67%),其中16例有HPV+。抗PD-L1抗体durvalumab与SBRT的组合目前正在NCT03618134中进行测试,这是一项专门针对HPV+OPSCC患者的Ib/II期试验。
在CheckMate-358的新辅助治疗环境中,也研究了nivolumab单一疗法的作用,在HPV阳性(12%)和HPV–(8.3%)患者中观察到低放射反应率。本研究中未发现pCR,在HPV+疾病患者中,17名接受评估的患者中只有一名出现主要病理反应(MPR),另有3名患者出现部分病理反应。在涉及28名OPSCC患者(其中24名患者有p16+肿瘤)的Ib期CIAO试验中,29%的患者有MPR,并且未观察到添加抗CTLA-4抗体Tremelimumab的益处增加。然而,用于评估病理反应的标准的差异使得比较这些不同的新辅助试验的数据变得困难,作为单一疗法接受新辅助抗PD-1/PD-L1抗体治疗的HNSCC患者的病理反应率似乎低于其他几种癌症患者的病理反应率。
基于E6和/或E7的治疗性疫苗长期以来一直被研究用于宫颈癌的治疗,然而不幸的是,到目前为止没有任何显著的临床成功。针对E6和/或E7的几种治疗性疫苗已进入HPV+OPSCC患者的试验,目前有许多研究正在测试与ICI或其他免疫调节剂的组合。
在nivolumab与HPV-16E6/E7肽疫苗(ISA 101)联合的II期试验中,22名HPV+OPSCC患者的ORR为36%,平均OS持续时间为17.5个月,与nivolumab单药治疗试验的数据相比具有优势。MEDI0457(一种编码HPV-16和HPV-18的E6和E7抗原的DNA疫苗)联合nivolumab在21例局部晚期p16+HNSCC患者的在I/IIa阶段试验中,有18例诱导了持久的HPV特异性免疫应答,其中包括一名转移性患者出现完全的快速持久响应。其他正在进行的试验包括HARE-40,一项I/II期剂量递增试验(NCT03418480),旨在确定E7靶向mRNA疫苗与激动性抗CD40抗体联合的安全性;以及第一项研究新型E6/E7靶向疫苗HB-201的人类I/II期试验,有无联合免疫检查点抑制(NCT0418015和NCT03669718)。这些试验和其他试验的结果将对推进HPV+OPSCs患者免疫治疗的持续进展至关重要。
小结
近20年来,包括口腔癌、喉癌在内多种头颈部肿瘤的发病率呈稳定或略微下降趋势,但口咽癌的发病呈上升趋势,其中HPV+OPSCC的比例尤其明显,多发与年轻男性。
由于这些肿瘤对抗肿瘤免疫的敏感性,免疫疗法是改善发病率和死亡率的非常具有前景的方向。因此,这需要我们更好地理解这种疾病的分子基础和临床过程,以识别和验证诊断、预后和预测性生物标志物,以提高早期发现率并对患者进行分层,以强化潜在的免疫治疗手段,最终改善患者预后。
参考文献:
1.HPV-associated oropharyngeal cancer:epidemiology, molecular biology and clinical management. Nat Rev Clin Oncol. 2022 Feb 1 : 1–22.
作者:小药说药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#免疫治疗# #流行病学# #分子机制# #HPV+OPSCC#
42