Nature Medicine:从自动胰岛素输送到全功能人造胰腺:1型糖尿病治疗的突破
2024-03-10 生物探索 生物探索
全自动人造胰腺的研究和试验正在全球范围内积极进行中,许多研究已经展示了这些系统在提高血糖控制、减少低血糖事件以及改善患者生活质量方面的巨大潜力。
引言
自动胰岛素输送系统的历史可追溯到上世纪60年代,当时科学家们首次尝试开发能够模拟人体胰腺功能的设备。最初的设备被称为“背包”,由Arnold Kadish设计,虽然其体积庞大且实用性有限,但它开启了穿戴式胰岛素泵和连续血糖监测系统(CGM)的发展之路。随着技术的进步,1970年代末,商用的连续皮下胰岛素输送(CSII)泵问世,为I型糖尿病(T1D)患者提供了更加灵活和精确的胰岛素管理方案。这些早期的CSII泵虽然功能有限,但它们的出现标志着糖尿病管理进入了一个新的时代。
21世纪初,随着第一款商用CGM系统的获批,自动胰岛素输送技术迈出了重要一步。这些系统能够实时监测血糖水平,为患者提供了前所未有的血糖控制能力。CGM系统的出现不仅改善了糖尿病患者的血糖管理,还为后续的自动胰岛素输送系统的发展奠定了基础。
自动胰岛素输送系统的最终目标是实现全自动人造胰腺,即一个能够根据实时血糖水平自动调节胰岛素输送的闭环系统。这一概念最早由Arnold Kadish提出,经过数十年的研究和发展,这一梦想正逐步成为现实。随着技术的不断进步,研究人员和工程师们开发出了越来越先进的算法和设备,使得自动胰岛素输送系统更加精确和可靠。从最初的低血糖暂停(LGS)功能到今天的预测性低血糖暂停和混合闭环系统,这些技术的演进不断推动着全自动人造胰腺的发展。
当前,全自动人造胰腺的研究和试验正在全球范围内积极进行中,许多研究已经展示了这些系统在提高血糖控制、减少低血糖事件以及改善患者生活质量方面的巨大潜力。随着更多创新技术的应用和临床试验的成功,全自动人造胰腺的实现指日可待,这将为T1D患者带来革命性的改变。3月6日Nature Medicine对相关进展也进行了回顾“Type 1 diabetes: from the dream of automated insulin delivery to a fully artificial pancreas”。
自动胰岛素输送系统的技术进展
持续皮下胰岛素输送(CSII)泵的发展
持续皮下胰岛素输送泵,简称CSII泵,作为糖尿病治疗领域的一项重要创新,已经显著改善了1型糖尿病(T1D)患者的治疗效果和生活质量。从最早的原型到现今的高度集成化设备,CSII泵的演进反映了医疗技术的快速发展以及对糖尿病管理需求的深入理解。
初始阶段:早期探索
CSII泵的历史可以追溯到20世纪70年代,当时的设备虽然实现了持续胰岛素输送的基本功能,但体积庞大且操作复杂,限制了其广泛应用。然而,这些早期的尝试为后续技术的进步奠定了基础,标志着向自动化糖尿病管理转变的重要一步。
技术突破:微型化与智能化
随着微电子学和材料科学的发展,CSII泵经历了一系列重大技术革新。这些泵逐渐变得更小巧、更轻便,患者可以方便地佩戴在身上,几乎不受日常活动的影响。此外,智能化的控制系统使得泵能够更准确地模拟人体的胰岛素分泌模式,提高了治疗的精确度和个性化程度。
用户体验的改善:从患者需求出发
设计师和工程师在CSII泵的开发过程中越来越注重用户体验。通过对患者需求的深入了解,新一代CSII泵不仅功能强大,而且操作简便,患者可以轻松进行个性化设置。此外,与移动应用和健康管理平台的集成,使患者和医生能够实时监控治疗数据,进一步提升了糖尿病的管理效率和效果。
朝着全自动人造胰腺迈进
CSII泵的不断进步为实现全自动人造胰腺——一个能够根据实时血糖水平自动调整胰岛素输送的系统——奠定了坚实的基础。当前的研究和开发正集中于提高泵的智能化水平,使其能够更准确地预测和响应患者的胰岛素需求,从而实现更加精细和自主的糖尿病管理。
实时连续血糖监测(CGM)系统
实时连续血糖监测(CGM)系统是管理1型糖尿病(T1D)不可或缺的一部分,其技术革新极大地改善了患者的生活质量并优化了血糖控制。CGM系统通过持续监测患者的血糖水平,为患者和医疗团队提供了前所未有的血糖管理能力。
CGM系统的技术演进
CGM技术自推出以来,经历了多代产品的更新。早期系统虽然能够提供连续的血糖读数,但由于其较大的尺寸、复杂的使用流程及较低的准确性,限制了其普及。随着传感器技术、微电子学和数据处理技术的进步,最新一代CGM系统已经变得更加小巧、使用更为便捷,且准确性大幅提高。
CGM系统对糖尿病管理的影响
CGM系统对于提高糖尿病患者的血糖控制水平具有重要意义。通过实时监测血糖水平,患者可以即时调整饮食、运动和胰岛素剂量,从而更有效地管理血糖波动。此外,CGM系统还能够预警潜在的高血糖或低血糖事件,极大地降低了这些血糖异常对患者健康的威胁。
CGM系统的未来发展趋势
随着技术的不断进步,未来的CGM系统将更加智能化和个性化。基于人工智能算法的数据分析能力将使CGM系统不仅能够提供实时血糖读数,还能够预测血糖趋势并向患者提供个性化的管理建议。此外,未来的CGM系统可能会与可穿戴设备、智能手机等其他设备更紧密地集成,为患者提供一个全面的健康管理生态系统。
CGM系统与自动胰岛素输送系统的融合
CGM系统与自动胰岛素输送(AID)系统的融合是糖尿病技术发展的重要趋势之一。这种集成化的治疗方案能够根据CGM系统提供的实时血糖数据自动调整胰岛素泵的输送,实现更加精细和个性化的血糖控制。这种闭环系统的发展,标志着向全自动人造胰腺迈出了重要一步。
低血糖暂停(LGS)与预测性LGS系统
在糖尿病管理中,避免低血糖事件的发生是至关重要的,特别是对于需要密切监控血糖水平的1型糖尿病(T1D)患者。低血糖暂停(LGS)系统和预测性LGS系统的出现,为减少低血糖风险提供了革命性的解决方案。
低血糖暂停(LGS)系统的工作原理
LGS系统与持续皮下胰岛素输送泵(CSII泵)和实时连续血糖监测(CGM)系统相结合,能够实时监控患者的血糖水平。当系统检测到血糖水平低于预设的安全阈值时,它会自动暂停胰岛素的输送,防止血糖进一步下降,从而避免低血糖事件的发生。
预测性LGS系统的技术进步
预测性LGS系统在LGS的基础上进一步发展,不仅能够响应当前的低血糖状态,还能够预测血糖水平的趋势。通过高级算法分析CGM提供的血糖数据,系统能够预见到血糖即将下降至危险水平,并在此之前就自动调整胰岛素输送,更加主动地预防低血糖事件的发生。
LGS系统在糖尿病管理中的作用
LGS系统和预测性LGS系统为T1D患者提供了额外的安全网,减轻了患者对低血糖的担忧,使他们能够更加自信地管理自己的疾病。这些系统特别适用于夜间,当患者可能无法感觉到低血糖症状时,能够有效地减少无症状低血糖事件,提高患者的睡眠质量和生活质量。
LGS系统的未来发展
随着技术的不断进步和算法的持续优化,预测性LGS系统的准确性和可靠性将进一步提高。未来的系统可能会更加智能化,能够根据患者的生活习惯、活动水平和饮食模式进行个性化调整,实现更加精准和个性化的低血糖预防。此外,随着人工智能和机器学习技术的融入,预测性LGS系统将能够更好地适应患者的变化,为糖尿病患者提供更加全面和主动的保护。
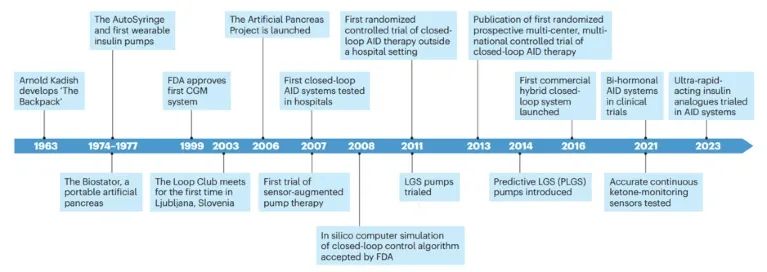
自动胰岛素输送系统的技术和临床发展(Credit: Nature Medicine)
朝全自动人造胰腺的步伐
传感器增强泵疗法
在追求全自动人造胰腺的进程中,传感器增强泵疗法(SAP)成为了一个重要的里程碑。它通过将实时连续血糖监测(CGM)系统与持续皮下胰岛素输送泵(CSII泵)结合起来,实现了对1型糖尿病(T1D)患者血糖水平的更精确调节。
SAP技术的核心优势
SAP技术的核心在于其能够提供实时的血糖水平反馈,并根据这些信息自动调整胰岛素泵的输送率。这一过程减少了患者手动监测和调节胰岛素的需求,从而降低了出错的风险,增加了血糖控制的准确性和稳定性。
SAP技术的实际应用
在实际应用中,SAP技术使患者能够看到自己血糖水平的即时变化,以及胰岛素泵如何对这些变化作出响应。这不仅帮助患者更好地理解自己的糖尿病管理,也为医生提供了宝贵的数据,以便进行更为个性化的治疗计划调整。
面临的挑战和解决方案
尽管SAP技术带来了显著的改进,但在实际操作中仍然面临一些挑战,例如传感器的准确性、设备的可靠性以及用户界面的友好性等。为了克服这些挑战,研发团队正不断改进传感器技术,提高数据处理算法的智能化水平,并优化用户界面设计,使其更加直观易用。
展望未来,SAP技术将继续向更高的智能化、集成化方向发展。未来的系统将更加精准地预测血糖变化趋势,实时调整胰岛素输送策略,甚至能够自动识别和适应患者的生活模式变化。这些进步将使SAP技术在实现全自动人造胰腺的道路上迈出更坚实的一步,为T1D患者带来更加自由和高质量的生活。
混合闭环系统:过渡技术的角色
在实现全自动人造胰腺的旅程中,混合闭环系统扮演了不可或缺的过渡角色。这种系统集成了实时连续血糖监测(CGM)和持续皮下胰岛素输送(CSII)泵的功能,能够自动调节大部分胰岛素的输送,但仍需用户参与部分决策,如饮食时的胰岛素剂量调整。
混合闭环系统的工作原理
混合闭环系统通过先进的算法分析CGM提供的血糖数据,自动调整CSII泵的胰岛素输送速率,以维持血糖水平在目标范围内。系统能够预测血糖趋势,并在检测到血糖即将偏离目标范围时主动调节胰岛素输送,减少用户的干预需求。
混合闭环系统的临床效益
混合闭环系统在提高血糖控制水平、降低低血糖风险以及改善患者生活质量方面展现出显著的潜力。通过自动调节胰岛素剂量,该系统能够减少血糖的剧烈波动,为患者提供更稳定的血糖管理方案。
面临的挑战
尽管混合闭环系统取得了显著进步,但在实现完全自动化管理前仍面临一些挑战,包括提高系统的准确性、可靠性和用户友好性,以及解决餐后血糖控制的问题。此外,教育和培训对于确保患者能够正确使用这一技术也至关重要。
随着技术的不断进步,混合闭环系统正逐步向全自动人造胰腺迈进。未来的系统将更加智能化,能够更准确地预测和应对血糖波动,减少甚至消除用户的干预需求。此外,系统的集成化和模块化将为患者提供更加个性化和便捷的糖尿病管理方案。
全闭环自动胰岛素输送系统的研究
全闭环自动胰岛素输送系统,常被视为“人造胰腺”的终极形态,旨在彻底自动化1型糖尿病(T1D)患者的血糖管理。该系统通过集成实时连续血糖监测(CGM)技术与持续皮下胰岛素输送(CSII)泵,无需用户干预即可实现血糖的精确控制。
全闭环系统的工作机制
全闭环系统通过实时监测患者的血糖水平,并根据预设的血糖目标范围自动调节胰岛素泵的输送速率。系统中的控制算法会根据CGM数据预测血糖趋势,并提前作出调整,以避免血糖过高或过低的情况发生。
提高血糖控制的潜力
全闭环系统为T1D患者提供了一种前所未有的血糖管理方式。通过实现24小时不间断的血糖监控与胰岛素调节,该系统能显著降低患者的血糖波动,减少低血糖和高血糖事件的发生,从而提高患者的长期血糖控制水平及生活质量。
面临的挑战
尽管全闭环系统展现出巨大的潜力,但在实际应用中仍面临诸多挑战。这些挑战包括但不限于算法的准确性与适应性、设备的可靠性、用户的接受度以及长期的安全性评估。此外,个体间的生理差异也要求系统具有高度的个性化调节能力。
当前,全球多个研究机构和企业正在积极开展全闭环系统的研究与开发工作。通过不断的临床试验和技术迭代,全闭环系统的性能正逐步提升。未来,随着算法智能化水平的提高以及生物传感器技术的进步,全闭环自动胰岛素输送系统有望成为T1D管理的新标准。
创新驱动:公司与糖尿病患者的共同努力
糖尿病技术领域的新兴企业
在全球范围内,新兴企业正在以其创新能力和灵活性推动糖尿病管理技术的发展。这些企业通过开发先进的监测设备、智能胰岛素泵、以及基于云计算和大数据的管理平台,为糖尿病患者提供了更加个性化和高效的治疗方案。新兴企业通常具有强烈的创新意识和快速的产品开发周期,使它们能够迅速将最新的科研成果转化为实用的糖尿病管理解决方案。这些企业在可穿戴设备、人工智能算法、远程医疗和患者教育等领域的探索,不仅提升了血糖监测和胰岛素输送的准确性和便捷性,也极大地丰富了糖尿病管理的维度。
尽管面临着资金、市场准入和监管审批等挑战,新兴企业仍然通过与医疗机构、研究组织和患者社群的合作,不断优化其产品和服务。此外,随着全球糖尿病患病率的上升以及数字医疗技术的普及,这些企业在糖尿病技术领域的创新活动将面临更广阔的市场机遇。
糖尿病患者社群的贡献
糖尿病患者社群在推动糖尿病管理技术进步中发挥着越来越重要的作用。通过社交媒体、论坛和自我管理应用,患者之间的信息交流和经验分享为技术创新提供了宝贵的用户反馈和需求洞察。
在患者社群中,一些技术熟练的患者和开发者通过开源项目合作开发了多种DIY糖尿病管理工具,如自定义胰岛素泵控制系统和数据可视化平台。这些解决方案往往更加贴合患者的实际需求,提供了传统医疗产品无法覆盖的个性化功能。
糖尿病患者社群不仅是技术创新的受益者,更是创新过程的重要参与者。他们的实际使用经验和需求反馈对新兴企业的产品设计和迭代至关重要,有助于推动更加人性化和高效的糖尿病管理解决方案的开发。
朝全自动人造胰腺的未来展望
连续酮体和乳酸监测
随着自动胰岛素输送(AID)系统的不断发展,新型的生物监测技术,如连续酮体和乳酸监测,正在成为提高AID系统性能的关键因素。这些监测技术不仅能为糖尿病患者提供更全面的健康信息,也为实现全自动人造胰腺的目标提供了新的可能性。
连续酮体监测的重要性
酮体是体内糖尿病患者由于胰岛素不足而产生的代谢产物,其水平的异常升高是糖尿病酮症酸中毒(DKA)的主要标志之一。通过连续监测酮体水平,AID系统能够及时发现患者的代谢异常,预防DKA的发生,从而提高治疗的安全性。
连续乳酸监测的潜力
乳酸是人体在缺氧状态下产生的一种物质,其水平的升高通常与组织缺氧或过度运动有关。在糖尿病管理中,连续乳酸监测能够帮助评估患者的身体状态,特别是在运动或其他高能耗活动中,为AID系统提供重要的调节依据。
监测技术对AID系统的影响
集成了连续酮体和乳酸监测的AID系统能够提供更为全面的代谢状态信息,使系统能够更加精确地调节胰岛素的输送。这种高度集成化的监测能力,将AID系统从单一的血糖控制工具转变为全面的代谢管理平台。
技术发展的挑战
尽管连续酮体和乳酸监测技术具有巨大的应用潜力,但目前仍面临一些技术和临床应用的挑战。这包括提高传感器的稳定性和准确性、延长传感器的使用寿命、以及确保监测数据的实时性和可靠性。
超快速作用胰岛素类似物和双激素系统
在追求全自动人造胰腺的进程中,超快速作用胰岛素类似物和双激素系统的研发成为了重要的里程碑。这些新疗法的出现,为提高自动胰岛素输送(AID)系统的性能和效率提供了新的可能性。
超快速作用胰岛素类似物的优势
超快速作用胰岛素类似物能够在注射后迅速发挥作用,缩短胰岛素起效时间,更加贴近人体自然分泌胰岛素的速率。这种胰岛素的快速响应特性,使得AID系统能够更加精确地调节血糖水平,特别是在饮食导致的血糖波动较大时,能够有效减少高血糖的风险。
双激素系统的工作原理
双激素系统不仅输送胰岛素以降低血糖,还能够输送胰高血糖素类似物来防止低血糖的发生。这一系统能够模拟健康胰腺的工作方式,根据血糖水平的实时变化,自动调节两种激素的输送,实现更加平稳和自然的血糖控制。
提高AID系统性能的潜力
超快速作用胰岛素类似物和双激素系统的结合使用,为全自动人造胰腺的实现提供了强有力的支持。这些新疗法能够提高AID系统对血糖波动的响应速度和准确性,特别是在控制餐后血糖和预防低血糖方面展现出巨大的优势。
虽然超快速作用胰岛素类似物和双激素系统在理论上具有巨大的应用潜力,但在实际应用中仍面临着诸多挑战,包括激素稳定性、输送系统的精确性、以及长期安全性等问题。未来的研究需要解决这些问题,同时,随着技术的不断进步和临床试验的深入,这些新疗法有望在不久的将来为糖尿病患者带来更加有效和安全的治疗方案。
未来的技术和治疗策略
随着科技的不断进步,全自动人造胰腺系统的研发正在迈向新的里程碑。未来的技术和治疗策略将更加精细化、个性化,以满足1型糖尿病(T1D)患者多样化的需求,进一步提升糖尿病管理的效率和效果。
智能化算法的进步
未来的人造胰腺系统将更加依赖于高度智能化的算法,这些算法能够实时分析患者的血糖数据、饮食习惯、生活方式及其他健康参数,从而进行更为精确的胰岛素剂量调节。通过大数据和机器学习技术的应用,这些算法将不断自我优化,提供更加个性化的糖尿病治疗方案。
穿戴式技术的融合
未来的人造胰腺系统将更广泛地利用穿戴式技术,如智能手表、健康监测贴片等,以无创或微创方式实时监测患者的生理指标。这些技术的融合不仅能够提供更为全面的健康数据,还能提高患者使用人造胰腺系统的舒适度和便捷性。
多参数监测技术的发展
除了血糖监测外,未来的人造胰腺系统还将集成多种生理参数监测技术,如连续酮体监测、乳酸水平监测等,以全面评估患者的代谢状态。这些多参数监测技术的集成将使人造胰腺系统能够更全面地理解患者的健康状况,实现更为精细的糖尿病管理。
治疗策略的多样化
随着研究的深入,未来的人造胰腺系统可能不仅限于胰岛素的输送。研究人员正在探索包括胰岛素类似物、胰高血糖素样肽-1(GLP-1)激动剂、双激素治疗策略(如胰岛素和胰高血糖素)在内的多种治疗手段,以更全面地模拟人体的生理机制,实现更优的血糖控制效果。
Q&A
全自动人造胰腺如何工作?
全自动人造胰腺系统结合了实时连续血糖监测(CGM)技术和持续皮下胰岛素输送(CSII)泵。系统通过智能算法实时分析血糖数据,并根据需要自动调整胰岛素输送,以保持血糖水平在目标范围内。
全自动人造胰腺系统的主要组成部分有哪些?
全自动人造胰腺系统主要包括三个核心部分:一个连续监测血糖水平的CGM设备,一个根据CGM数据调节胰岛素输送的CSII泵,以及一个内置智能算法的控制器,用于分析数据并做出决策。
全自动人造胰腺系统与现有糖尿病治疗方法相比有何优势?
与传统糖尿病治疗方法相比,全自动人造胰腺系统能够提供更加连续和精确的血糖控制,减少低血糖和高血糖事件的发生,降低患者的管理负担,改善患者的生活质量。
全自动人造胰腺系统面临的主要挑战是什么?
全自动人造胰腺系统面临的挑战包括提高系统的准确性和可靠性、确保患者的使用安全、以及满足不同患者的个性化需求。此外,技术的推广和普及还需克服经济成本和医疗体系整合的障碍。
全自动人造胰腺的未来发展方向是什么?
未来的全自动人造胰腺系统将更加智能化和个性化,通过引入更先进的监测技术和治疗策略,实现更精确的血糖控制。同时,研究人员也在探索新的治疗方法,如双激素系统,以进一步完善系统性能。
参考文献
Phillip M, Kowalski A, Battelino T. Type 1 diabetes: from the dream of automated insulin delivery to a fully artificial pancreas. Nat Med. Published online March 6, 2024. doi:10.1038/d41591-024-00013-5
Pfeiffer, E., Thum, Ch. & Clemens, A. Horm. Metab. Res. 6, 339–342 (1974).
Bergenstal, R.M. et al. N. Engl. J. Med. 369, 224–232 (2013).
Battelino, T. & Phillip, M. J. Pediatr. Endocrinol. Metab. 17, 375–376 (2004).
Kowalski, A.J. Diabetes Technol. Ther. 11 S1, S113–S119 (2009).
Bergenstal, R.M. et al. N. Engl. J. Med. 363, 311–320 (2010).
Battelino, T., Nimri, R., Dovc, K., Phillip, M. & Bratina, N. Diabetes Care 40, 764–770 (2017).
Hovorka, R. et al. Lancet 375, 743–751 (2010).
Phillip, M. et al. N. Engl. J. Med. 368, 824–833 (2013).
Tauschmann, M. et al. Lancet 392, 1321–1329 (2018).
Armiger, R., Reddy, M., Oliver, N.S., Georgiou, P. & Herrero, P. J. Diabetes Sci. Technol. 16, 29–39 (2022).
Biester, T. et al. Diabetes Obes. Metab. 23, 599–608 (2021).
Alva, S., Castorino, K., Cho, H. & Ou, J. J. Diabetes Sci. Technol. 15, 768–774 (2021).
Nwokolo, M. et al. Diabetes Technol. Ther. 25, 856–863 (2023).
Blauw, H., Onvlee, A.J., Klaassen, M., van Bon, A.C. & DeVries, J.H. Diabetes Care 44, 836–838 (2021).
Tsoukas, M.A. et al. Lancet Digital Heal 3, e723–e732 (2021).
作者:生物探索
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#自动胰岛素输送# #人造胰腺# #1型糖尿病#
18