JCEM:PD-1和CTLA-4阻断剂会增加甲状腺功能障碍的风险
2021-11-23 MedSci原创 MedSci原创
该研究的结果表明,即使在基线ATAs阴性的患者中,PD-1/CTLA-4-Abs治疗后甲状腺irAE的发生率也很高且不容忽视。
先前的研究表明,在基线时抗甲状腺抗体(ATAs)阴性的患者接受抗程序性细胞死亡1抗体(PD-1-Ab)治疗引起甲状腺功能障碍(甲状腺免疫相关不良事件[irAEs])的风险较低,约为2-7%,在ATAs阳性的患者中其风险要高得多(约为30-50%)。然而,使用PD-1-Ab联合抗细胞毒性T淋巴细胞抗原4抗体(CTLA-4-Ab)治疗是否会引起甲状腺功能障碍风险类似的升高尚未明确。

近日,内分泌和代谢性疾病领域权威杂志Journal of Clinical Endocrinology & Metabolism上发表了一篇研究文章,研究人员共评估了451名接受PD-1-Ab、CTLA-4-Ab或PD-1-Ab加CTLA-4-Ab(PD-1/CTLA-4-Abs)治疗的恶性肿瘤患者基线时的ATAs情况,以及治疗开始后24周内每6周评估一次甲状腺功能,然后观察至最后一次临床随访。

在451名患者中,51名患者在接受免疫治疗后发生甲状腺irAE[416名中的41名(9.9%)患者接受PD-1-Ab治疗,8名中的0名(0%)患者接受CTLA-4-Ab治疗,27名中的10名(37.0%)患者接受PD-1/CTLA-4-Abs治疗]。
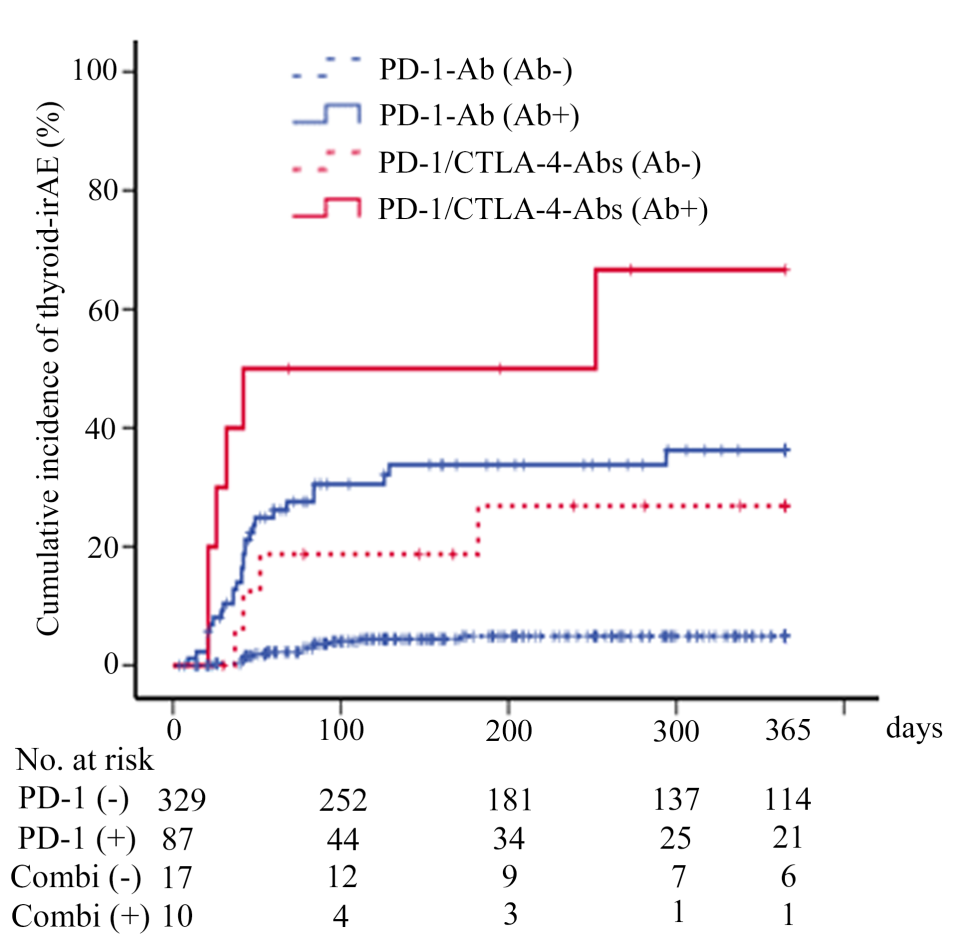
接受两种PD-1-Ab[28/87(32.2%) vs. 13/329(4.0%),p<0.001]和PD-1/CTLA-4-Abs[6/10(60.0%) vs. 4/17(23.5%),p<0.05]治疗后基线ATA阳性与阴性患者的甲状腺irAE累积发生率显著更高。在基线ATAs阴性的患者中,PD-1/CTLA-4Abs治疗后的甲状腺-irAEs风险显著高于PD-1-Ab诱发的风险;在基线时ATAs阳性的患者中,PD-1-Ab诱发的甲状腺-irAEs风险无统计学差异。
由此可见,该研究的结果表明,即使在基线ATAs阴性的患者中,PD-1/CTLA-4-Abs治疗后甲状腺irAE的发生率也很高且不容忽视。
原始出处:
Shintaro Iwama.et al.Increased risk of thyroid dysfunction by PD-1 and CTLA-4 blockade in patients without thyroid autoantibodies at baseline.JCEM.2021.https://academic.oup.com/jcem/advance-article-abstract/doi/10.1210/clinem/dgab829/6428577?redirectedFrom=fulltext
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




/macrophage_engulfing_bacteria2-4ee42b38ea984917aaa7e14bc18515a3.jpg)





#JCEM#
46
#阻断剂#
51
#JCE#
40
#阻断#
42
#功能障碍#
37