J Nucl Med:放射性药物177DOTA-ZOL治疗骨转移瘤的安全性和剂量评估
2021-01-27 MedSci原创 MedSci原创
与其他放射性药物相比,177Lu-DOTA-ZOL治疗成骨细胞骨转移瘤是安全的,并且具有良好的治疗指数。
众所周知,使用放射性标记的双膦酸盐治疗骨转移是一个已被证明的安全有效的姑息性疗法。177Lu-DOTA-唑来膦酸(177Lu-DOTA-ZOL)是一种新的治疗骨转移的放射性药物。
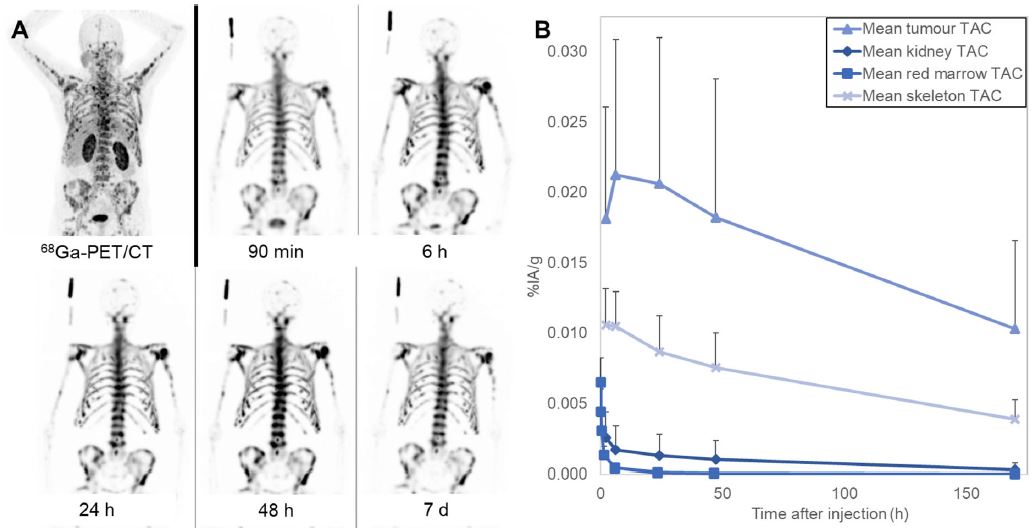
这是一项前瞻性的研究,研究人员基于一系列SPECT/CT影像和血样评估了单次治疗剂量的177DOTA-ZOL的安全性和剂量学。招募了9位在常规治疗下病情进展的有广泛性骨转移的转移性去势耐受性前列腺癌(mCRPC)患者(70.8±8.4岁)。在接受了5780±329MBq 177Lu-DOTA-ZOL后7天内,患者接受了3D全身SPECT/CT扫描和静脉采血。对主要器官和肿瘤病灶进行剂量学评估。通过血液生物标志物评估安全性。
在所有患者中,骨病灶快速摄取177Lu-DOTA-ZOL,并高滞留;同时177Lu-DOTA-ZOL从血流中快速清除。注射后6个小时,肿瘤病灶内平均滞留量为0.02% IA/g;在注射后170个小时,肿瘤病灶内平均滞留量为0.01% IA/g。
在该队列中,骨肿瘤病灶、肾脏、红骨髓和骨表面的平均吸收剂量分别为4.21、0.17、0.36和1.19 Gy/GBq。红骨髓被发现是所有患者的剂量限制器官。6.0 GBq的中位最大耐受注射活性可能会超过每个患者的红骨髓的定义阈值2 Gy。
总而言之,与其他放射性药物相比,177Lu-DOTA-ZOL治疗成骨细胞骨转移瘤是安全的,并且具有良好的治疗指数。然而,应考虑个体化剂量测定,以避免个别患者出现严重的血液毒性。
原始出处:
Fernandez Rene,Eppard Elisabeth,Lehnert Wencke et al. Evaluation of safety and dosimetry of Lu DOTA-ZOL for therapy of bone metastases. J Nucl Med, 2021, undefined: undefined.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#骨转移瘤#
50
#放射性药物#
49
#转移瘤#
50
#Med#
53
学习了,涨知识了!
78