论著|结构化认知康复治疗在新加坡脑卒中后认知功能障碍患者中的应用效果分析
2024-08-18 中国神经精神疾病杂志 中国神经精神疾病杂志
卒中发作次数、脑白质高信号程度和深部微出血等脑血管病危险因素影响认知康复治疗的预后。然而,这些发现仍需进一步研究验证,且可指导未来临床试验的设计。
摘 要
目的目前关于脑卒中后认知功能障碍(post stroke cognitive impairment, PSCI)预后的研究较少,尤其是关于接受结构化认知康复治疗但预后无显著改善患者的脑血管病危险因素尚未有报道。本研究旨在探讨影响认知康复治疗应用效果的脑血管病危险因素,为临床实践提供依据。
方法对149例缺血性脑卒中患者[年龄(63.60±9.66)岁,男性64.4%]进行为期8周的非药物结构化认知康复治疗,并收集纵向的预后数据。采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)和痴呆生活质量量表(dementia-quality of life instrument, DemQOL)在基线、治疗结束时和治疗结束后6个月进行整体认知功能和生活质量评估。最后通过回归分析评估结构化认知康复治疗对卒中后认知功能障碍预后的影响。
结果卒中发作次数更多的患者在接受结构化认知康复治疗结束时MoCA评分提高不明显(OR=2.17, 95%CI:0.98~4.81,P=0.056)。与基线相比,脑白质高信号程度越严重的患者在接受结构化认知康复治疗结束时MoCA评分提高越不明显(OR=2.13,95%CI:1.04~4.38,P=0.039)。存在深部微出血的患者在接受认知康复治疗后6个月MoCA评分改善不明显(OR=19.93,95%CI:1.04~384,P=0.047)。
结论卒中发作次数、脑白质高信号程度和深部微出血等脑血管病危险因素影响认知康复治疗的预后。然而,这些发现仍需进一步研究验证,且可指导未来临床试验的设计。
关键词 脑血管病;脑卒中后认知功能障碍;缺血性脑卒中;结构化认知康复治疗;认知功能
脑卒中是全球导致残疾和死亡的第二大病因,无论是在发达国家还是发展中国家,脑卒中幸存者都在增加。这是由于全球人口的老龄化以及急性期救治技术的进步,这些因素降低了脑卒中死亡率[1]。据统计,全球有超过8000万脑卒中患者,其中70%的卒中事件是缺血性卒中[2-3]。
新加坡的情况与此类似。脑血管疾病(包括急性卒中)在新加坡是第四大常见死因,占2019年新加坡总死亡人数的6%[4]。从2010年的5890例增加到2019年的8849例,全国新发脑卒中病例数不断增加[5]。随着发生率上升和死亡率下降,脑卒中成为第三大高负担疾病,占整体伤残调整生命年(disability-adjusted life years)的5.65%。在未来40年内,脑卒中相关痴呆的死亡率可能逐步上升,因此改善卒中后的认知康复治疗是减轻卒中负担的重要环节之一[6]。
卒中后认知功能损害(post stroke cognitive impairment, PSCI)是指卒中后在原本不存在认知功能缺陷的情况下发生的认知功能损害[7]。PSCI的患病率正在增加,既往研究认为腔隙性梗死是PSCI的主要原因[8]。近一半的轻度脑卒中患者存在认知功能障碍,其中包括许多轻微或无身体残疾的患者[8]。在轻度脑卒中患者中,研究报道PSCI的发生率为37.3%~61%不等[9]。由于对日常生活自理能力的负面影响,PSCI降低了患者生活质量(quality of life, QOL)并影响神经功能康复[10]。更让人担心的是,认知功能损害可能在卒中后3个月到1年内进展[11]。因此,需要全面的卒中后康复治疗方案来应对PSCI进展的风险,让脑卒中患者更容易重新融入社区。目前的卒中后康复方案往往造成较高的治疗经济负担[12],因为许多研究都集中在药物长期干预上[13]。一个可以改善PSCI的有效的非药物方案,包括相关的生活方式和认知功能障碍管理策略,可让卒中患者受益。
新加坡的认知康复治疗通常是多学科协作的一部分,包括物理治疗、职业治疗、语言治疗,也包括认知训练。但是,在新加坡推广认知康复的一个重大挑战,是缺乏受过专业训练且具备认知康复专业知识的医疗保健人员,并且缺乏卒中后认知康复治疗的标准化评估和治疗方案,因此提供标准化的循证医疗措施非常有挑战性。为满足卒中后认知功能障碍管理的需要,新加坡本地高级卒中中心组织了一个多学科协作小组,为轻度卒中患者制定了一套多领域、可扩展的脑卒中记忆康复(stroke memory rehabilitation, SMaRT)方案。该方案的目标是训练轻度认知功能障碍患者的自我管理技能,提高对PSCI预防策略的认识,支持患者重新参与社区活动和就业,降低患者认知功能损害进展的风险。
本研究纳入既往报道与PSCI相关的血管性危险因素,包括患者年龄和受教育程度[14]、男性[8]、卒中史和血管危险因素[15]、白质高信号(white matter hyperintensity, WMH)[16-17]、脑微出血[18]和梗死部位[19]。然而目前对PSCI干预预后影响因素的研究有限。一项针对中-重度卒中患者的研究发现,血管危险因素不影响神经和功能的整体恢复[20]。另一项针对老年患者的为期2年的生活方式干预试验显示,干预对认知功能改善有益,社会人口学资料、心血管疾病因素和心血管疾病合并症对认知功能干预的结果没有影响[21]。
为了完成研究目标,我们在轻度卒中患者中设计了为期8周的非药物临床干预试验,以探索结构化认知康复治疗的效果,并收集卒中预后相关的纵向数据。我们评估了影响轻度卒中患者非药物认知康复预后的基线变量,包括人口统计学特征、血管危险因素、MRI特征。此外,我们比较了慢性脑血管病(chronic cerebrovascular disease,CVD)患者和非CVD患者在治疗前后的认知和生活质量结果。
1 对象与方法
1.1 研究设计 本研究是一项前瞻性研究,旨在评估脑卒中患者对结构化认知康复治疗的反应。在新加坡三级医院(Tertiary Hospital)接受卒中治疗的患者中筛选符合条件的患者。纳入标准:①MRI证实的缺血性卒中;②患者主诉认知困难;③年龄18~80岁;④功能独立,定义为改良Rankin量表(modified Rankin scale, mRS)评分≤3分;⑤具备基本的英语或普通话水平;⑥能够在卒中后12个月内参加本试验。邀请符合这些纳入标准的患者参与研究,并取得其知情同意。所有的研究方案符合《赫尔辛基宣言》及当地临床研究规定,获得伦理委员会的批准。所有参与研究的患者都接受了相同的治疗方案,没有设置空白对照组。
1.2 脑卒中后认知康复方案 该方案是一项认知康复方案,包括每周2 h的小组会议,为期8周,强调将康复方法应用于日常生活。因PSCI需要联合干预,该方案包括认知策略、健康的生活习惯、放松技巧和目标设定[22],认知和身体干预相结合被认为对改善卒中幸存者的认知有效[23]。该方案已被程序化,并已被证明可推广到多个基层社区中心。
每例受试者每次治疗与临床团队的平均接触时间为90 min。疗效评估主要方法包括评估整体认知功能的蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)[24],以及痴呆生活质量量表(dementia-quality of life instrument,DemQOL)[25]。所有患者在3个时间点进行评估——干预前(基线)、8周康复治疗方案干预后立即(干预后立即)和方案干预后6个月(干预后6个月)。将基线得分与另外2个时间点的得分进行比较。图1展示了该方案的结构和时间线。
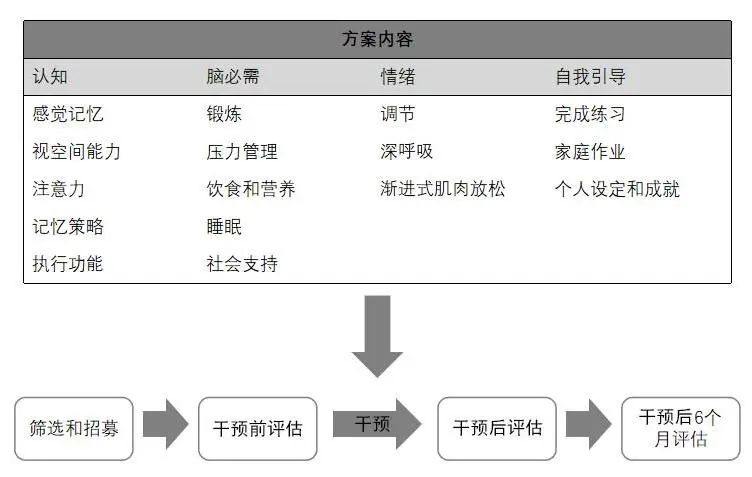
图1 康复治疗方案的流程
参加该研究时研究者记录受试者的人口统计学数据、受教育年限、病史和血管危险因素等临床数据。住院期间行脑MRI检查,并由放射科和神经科医生分别评估。根据病历获取卒中的发作次数,并根据部位和大小对急性梗死进行分类。使用Fazekas量表评估T2序列来量化WMH[26]。采用脑微出血解剖评估量表评估梯度回声序列的微出血分级[27]。在评分上的任何差异均经过协商一致解决。
1.3 统计学方法 连续变量以均数和标准差描述,分类变量以频数和百分比描述。采用线性混合模型分析MoCA和DemQOL结果,以检测各时间点评分的变化。分别计算基线、干预后立即和干预后6个月评估的平均值和95%置信区间(confidence interval,CI)。使用线性混合模型进行事后比较,以平均值和95% CI表示干预后相对于基线的变化。在模型中,年龄、性别、受教育年限和时间被列为固定影响因素。采用限制极大似然法估计协方差参数,在随机截距模型中,假设协方差矩阵是非结构化的。对人口学、临床和神经影像学结果进行单因素分析比较,包括独立样本t检验或连续数据的Mann-Whitney U检验(依赖于正态性假设),以及分类数据的χ2检验或Fisher精确检验。比较两个不同方案后时间点MoCA和DemQOL的改善情况。患者评分改善基于公认的认知功能障碍老年人的最小重要差异:MoCA增加≥2分,DemQOL增加≥5分。为了分析基线特征与MoCA和DemQOL结果改善的关系,调整年龄和受教育年限,对单变量分析中有统计学意义变量进行多变量二元logistic回归。采用Firth惩罚似然法来减少罕见事件引起的偏差。所有统计分析使用IBM SPSS Statistics for Windows, Version 23.0(Armonk, NY: IBM Corp.)进行。统计检验水准α=0.05。
2 结果
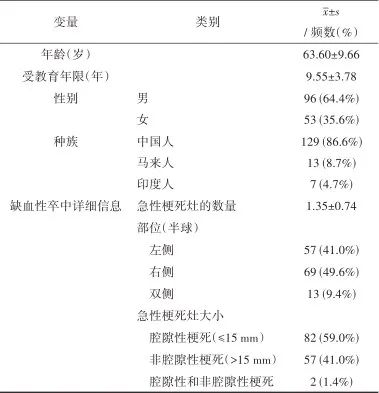
2.1 参与者人口统计学资料 2018年7月至2020年10月,共招募患者149例,年龄(63.60±9.66)岁,男性64.4%。表1给出了患者的人口统计数据和缺血性卒中的详细信息。
表1 人口统计学资料与缺血性卒中信息
2.2 患者治疗结果 MoCA(β=1.22, 95%CI:0.71~1.75)和DemQOL(β=4.60, 95%CI:2.08~7.11)评分在所有时间点有所改善,在控制年龄和受教育年限后,这些改善具有统计学意义(P<0.05)。见表2。
表2 脑卒中记忆康复(stroke memory rehabilitation, SMaRT)方案的结果测量

注:使用线性混合模型分析对基线与干预后立即、基线与干预后6个月进行两两比较,并使用Bonferroni校正对差异的最小二乘平均值(95%CI)进行调整。†均值差为固定时间点减去基线分数的均值差。缩写:vs.,对比;MoCA,蒙特利尔认知评估;DemQOL,痴呆生活质量量表;CI,置信区间。
2.3 评估基线、干预后立即和干预后6个月,以及与基线相比的组间差异 干预后立即评估,既往罹患卒中次数较多(U=1928, P=0.015)和重度WMH(χ2=3.902, P=0.048)的患者MoCA评分改善的可能性较小。在干预后6个月时,深部微出血较多的患者(P=0.002, Fisher精确检验)MoCA得分改善的可能性更小。干预后立即评估,重度WMH患者DemQOL改善的可能性较小(χ2=3.655, P=0.056),但这一趋势无统计学意义。表3和表4分别显示了基线特征与MoCA和DemQOL各时间点变化的关系。
表3 患者基线特征和MoCA的变化
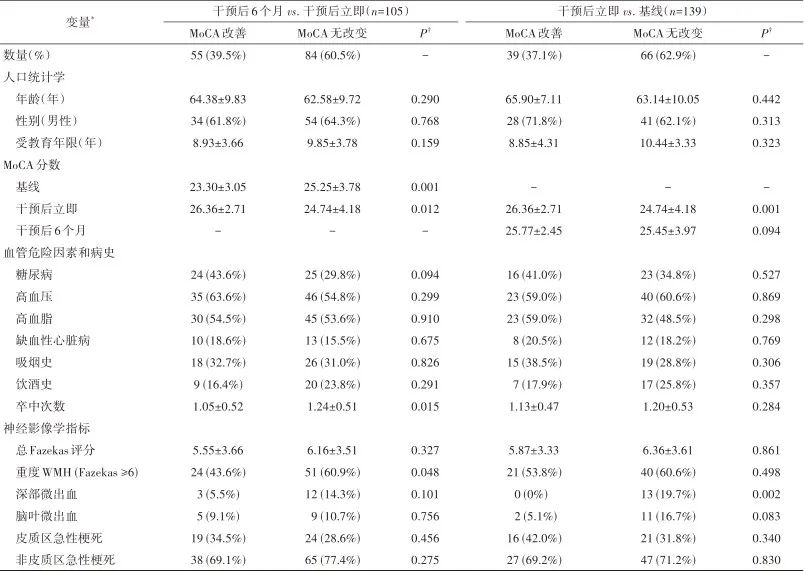
注:* 连续变量以均数±标准差描述,分类变量以频数和百分比描述。† 使用独立样本t检验或Mann-Whitney U检验对连续数据(取决于正态性假设)进行两组比较,使用χ2检验或Fisher精确检验对分类数据(适当时)进行两组比较。
表4 患者基线特征和DemQOL评分的变化
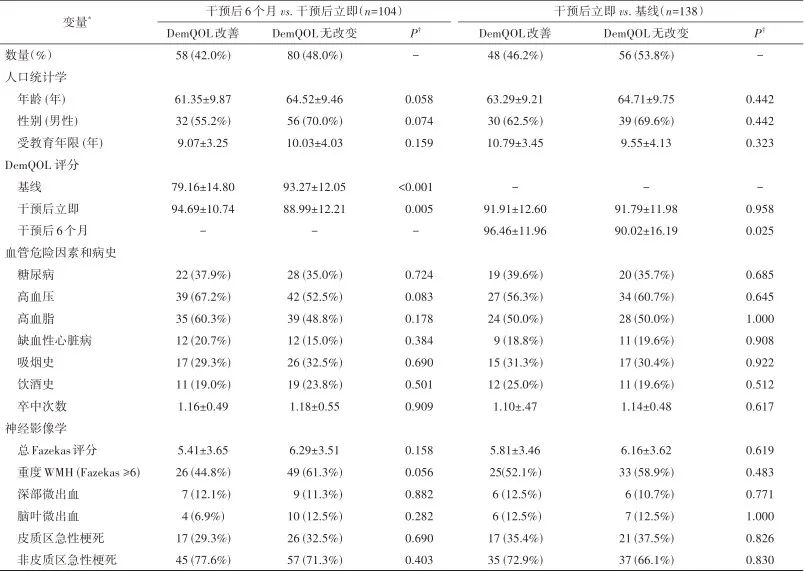
注:* 连续变量以均数±标准差描述,分类变量以频数和百分比描述。† 使用独立样本t检验或Mann-Whitney U检验对连续数据(取决于正态性假设)进行两组比较,使用χ2检验或Fisher精确检验对分类数据(适用时)进行两组比较。
2.4 与认知功能变化相关的变量 卒中罹患次数、重度WMH的存在和深部微出血显著降低了干预后立即和干预后6个月MoCA评分改善的可能性。患者每经历一次卒中,其干预后立即MoCA评分改善的可能性更小(OR=2.17,95%CI:0.98~4.81,P=0.056)。与基线相比,有重度WMH的患者在干预后立即MoCA评分改善的可能性较小(OR=2.13,95%CI:1.04~4.38,P=0.039)。最后,有深部微出血患者在干预后6个月MoCA评分改善的可能性较小(OR=19.93,95%CI:1.04~384,P=0.047)。血管因素如高脂血症、糖尿病和高胆固醇对生活质量或认知评分没有影响。
3 讨论
脑卒中后认知功能障碍是新加坡面临的一个重要问题,影响着大量的脑卒中幸存者。认知康复在脑卒中康复中扮演着重要的角色,可以预防认知功能障碍,改善认知功能,提高功能预后。尽管在新加坡推广PSCI康复治疗面临着重大挑战,但也有很大的改进潜力。结构化认知康复治疗小组方案的发展能够以具有成本效益的方式提高PSCI康复治疗服务的质量。这种康复方案已被证明可以提高轻度卒中患者的认知得分和生活质量,并且这些改善在康复结束后6个月仍然持续存在,这表明参与者能够记住在康复过程中学到的方法并将其融入日常生活。
既往卒中的次数、WMH的严重程度以及微出血的存在影响了轻度卒中幸存者接受结构化认知康复治疗后的认知表现。虽然以前的研究已经探讨了PSCI的危险因素,但本研究是第一个评估影响结构化认知康复治疗预后的因素。
既往卒中的次数被证明是结构化认知康复后认知预后的主要决定因素。因为卒中本身就会加速认知功能的下降,反复发作的卒中已被证明会使卒中后痴呆的风险翻1倍[30]。先前的研究发现,与没有反复卒中发作的患者相比,反复发作的患者出现认知功能下降的可能性要高出4倍[31]。随着卒中发作次数增加,白质束的累积损伤和全脑萎缩增加,这导致认知储备和适应性减低[32]。
WMH和微出血可以直接反映组织损伤,神经影像学研究一致认为WMH和微出血与认知功能障碍有关[16,18]。脑卒中患者的WMH与海马亚区(即海马下托、CA1、CA4、分子层和齿状回)选择性萎缩有关,这些区域对注意力持续时间、记忆检索和执行功能的最佳状态至关重要[33]。WMH也会对大脑中认知功能相关重要脑区的功能连接产生负面影响,其中融合型WMH对大脑连接的负面影响更大[34]。
WMH也与生活质量结果有关。WMH已被证明与抑郁的进展有关,抑郁会影响一个人的精神、情绪和身体健康,从而降低总体生活质量[36]。血管抑制假说为直接关联提供了一种可能的解释——血管病变导致的环路破坏通过影响神经环路使抑郁综合征易感、延续或加重[37]。WMH可间接影响生活质量,因为WMH与影响日常功能的运动、认知和情感环路的功能紊乱有关。
本研究的局限性包括样本量小,随访时间短,只有6个月。尽管样本量有限,本研究仍证明了基线变量,如卒中次数和慢性脑血管疾病对接受认知康复治疗的卒中幸存者的认知功能预后有不良影响。未来研究需要更长时间的随访,以了解与不良预后相关的变量在更长时间内是否仍然显著。此外,由于这是一项非药物临床介入研究,需要进一步设置对照组的临床试验来证实本研究结果。
这项研究的主要临床意义在于,轻度卒中患者接受结构化的认知康复治疗后,其预后情况将受到其既往病史和卒中前慢性脑血管疾病负担的影响。这一发现有助于优化临床试验的设计,以进一步验证本研究结果。此外,这也将推动精准医学策略在预防PSCI方面的发展,并有助于确定哪些患者可能需要更长时间和更高强度的认知康复治疗。值得注意的是,慢性脑血管危险因素可能不会直接影响康复后的预后,因此鼓励所有卒中患者积极参与康复治疗,而不仅仅是考虑其血管病史。导致康复后预后较差的变量通常可以在患者的病史中找到,并且这些变量提示康复后更容易发生PSCI。未来研究可以在这些发现的基础上进行,以便更有效地分配资源给卒中幸存者的风险群体,从而减轻全球卒中负担,确保所有卒中幸存者都能享有更高的生活质量。
参考文献
1. FEIGIN V L, STARK B A, JOHNSON C O, et al. Global, regional, and national burden of stroke and its risk factors, 1990 - 2019: A systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820.
2. World Stroke Organization. Why stroke matters[R/OL]. (2021-12-01) [2024-04-27]. https://www.world-stroke.org/world-strok e-day-campaign/why-stroke-matters.
3. PHIPPS M S, CRONIN C A. Management of acute ischemic stroke[J]. BMJ, 2020, 368: l6983.
4. Ministry of Health Singapore. Principal causes of death[R/OL]. (2023-08-03) [2024-04-27]. https://www.moh.gov.sg/resources-statistics/singapore-health-facts/principal-causes-of-death.
5. National Registry of Diseases Office. Singapore stroke registry annual report 2019[R/OL]. (2021-12-03) [2024-04-27]. https://www.nrdo.gov.sg/docs/librariesprovider3/default-document-libr ary/ssr-annual-report-2019.pdf?sfvrsn=594314c4_0.
6. MATTIUZZI C, LIPPI G. Worldwide disease epidemiology in the older persons[J]. Eur Geriatr Med, 2020, 11(1): 147-153.
7. CHANDER R J, LAM B Y K, LIN X, et al. Development and validation of a risk score (CHANGE) for cognitive impairment after ischemic stroke[J]. Sci Rep, 2017, 7(1): 12441.
8. JACOVA C, PEARCE L A, COSTELLO R, et al. Cognitive impairment in lacunar strokes: The SPS3 trial[J]. Ann Neurol, 2012, 72(3): 351-362.
9. AAM S, EINSTAD M S, MUNTHE-KAAS R, et al. Post-stroke cognitive impairment — Impact of follow-up time and stroke subtype on severity and cognitive profile: The Nor-COAST study[J]. Front Neurol, 2020, 11: 699.
10. JOKINEN H, MELKAS S, YLIKOSKI R, et al. Post-stroke cognitive impairment is common even after successful clinical recovery[J]. Eur J Neurol, 2015, 22(9): 1288-1294.
11. LO J W, CRAWFORD J D, DESMOND D W, et al. Long-term cognitive decline after stroke: An individual participant data meta-analysis[J]. Stroke, 2022, 53(4): 1318-1327.
12. RAJSIC S, GOTHE H, BORBA H H, et al. Economic burden of stroke: A systematic review on post-stroke care[J]. Eur J Health Econ, 2019, 20(1): 107-134.
13. SAINI V, GUADA L, YAVAGAL D R. Global epidemiology of stroke and access to acute ischemic stroke interventions[J]. Neurology, 2021, 97(20 Suppl 2): S6-S16.
14. JACQUIN A, BINQUET C, ROUAUD O, et al. Post-stroke cognitive impairment: High prevalence and determining factors in a cohort of mild stroke[J]. J Alzheimers Dis, 2014, 40(4): 1029-1038.
15. LO J W, CRAWFORD J D, DESMOND D W, et al. Profile of and risk factors for poststroke cognitive impairment in diverse ethnoregional groups[J]. Neurology, 2019, 93(24): e2257-e2271.
16. KANDIAH N, WIRYASAPUTRA L, NARASIMHALU K, et al. Frontal subcortical ischemia is crucial for post stroke cognitive impairment[J]. J Neurol Sci, 2011, 309(1-2): 92-95.
17. YATAWARA C, NG K P, CHANDER R, et al. Associations between lesions and domain-specific cognitive decline in poststroke dementia[J]. Neurology, 2018, 91(1): e45-e54.
18. YATAWARA C, GUEVARRA A C, NG K P, et al. The role of cerebral microbleeds in the incidence of post-stroke dementia[J]. J Neurol Sci, 2020, 412: 116736.
19. NARASIMHALU K, WIRYASAPUTRA L, SITOH Y Y, et al. Post-stroke subjective cognitive impairment is associated with acute lacunar infarcts in the basal ganglia[J]. Eur J Neurol, 2013, 20(3): 547-551.
20. MURIE-FERNÁNDEZ M, MARZO M M. Predictors of neurological and functional recovery in patients with moderate to severe ischemic stroke: The EPICA study[J]. Stroke Res Treat, 2020, 2020: 1419720.
21. ROSENBERG A, NGANDU T, RUSANEN M, et al. Multidomain lifestyle intervention benefits a large elderly population at risk for cognitive decline and dementia regardless of baseline characteristics: The FINGER trial[J]. Alzheimers Dement, 2018, 14(3): 263-270.
22. SUN J H, TAN L, YU J T. Post-stroke cognitive impairment: Epidemiology, mechanisms and management[J]. Ann Transl Med, 2014, 2(8): 80.
23. BO W, LEI M, TAO S, JIE L T, et al. Effects of combined intervention of physical exercise and cognitive training on cognitive function in stroke survivors with vascular cognitive impairment: A randomized controlled trial[J]. Clin Rehabil, 2019, 33(1): 54-63.
24. NASREDDINE Z S, PHILLIPS N A, BÉDIRIAN V, et al. The Montreal Cognitive Assessment, MoCA: A brief screening tool for mild cognitive impairment[J]. J Am Geriatr Soc, 2005, 53(4): 695-699.
25. SMITH S C, LAMPING D L, BANERJEE S, et al. Development of a new measure of health-related quality of life for people with dementia: DEMQOL[J]. Psychol Med, 2007, 37(5): 737-746.
26. FAZEKAS F, CHAWLUK J B, ALAVI A, et al. MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging[J]. AJNR Am J Neuroradiol, 1987, 8(3): 421-426.
27. GREGOIRE S M, CHAUDHARY U J, BROWN M M, et al. The Microbleed Anatomical Rating Scale (MARS). Reliability of a tool to map brain microbleeds[J]. Neurology, 2009, 73(21): 1759-1766.
28. NIJSSE B, VISSER-MEILY J M, VAN MIERLO M L, et al. Temporal evolution of post-stroke cognitive impairment using the montreal cognitive assessment[J]. Stroke, 2017, 48(1): 98-104.
29. LEE E C, WRIGHT J, WALTERS S J, et al. Estimating the minimum important difference in the DEMQOL instrument in people with dementia[J]. Qual Life Res, 2021, 30(10): 2995-3005.
30. MATZ K, TEUSCHL Y, FIRLINGER B, et al. Multidomain lifestyle interventions for the prevention of cognitive decline after ischemic stroke: Randomized trial[J]. Stroke, 2015, 46(10): 2874-2880.
31. PENDLEBURY S T, ROTHWELL P M. Prevalence, incidence, and factors associated with pre-stroke and post-stroke dementia: A systematic review and meta-analysis[J]. Lancet Neurol, 2009, 8(11): 1006-1018.
32. HACHINSKI V, EINHÄUPL K, GANTEN D, et al. Preventing dementia by preventing stroke: The Berlin Manifesto[J]. Alzheimers Dement, 2019, 15(7): 961-984.
33. WONG F C C, YATAWARA C, LOW A, et al. Cerebral small vessel disease influences hippocampal subfield atrophy in mild cognitive impairment[J]. Transl Stroke Res, 2021, 12(2): 284-292.
34. KUMAR D, VIPIN A, WONG B,et al. Differential effects of confluent and nonconfluent white matter hyperintensities on functional connectivity in mild cognitive impairment[J]. Brain Connect, 2020, 10(10): 547-554.
35. TANG W K, LIANG H J, CHEN Y K, et al. White matter hyperintensities and quality of life in acute lacunar stroke[J]. Neurol Sci, 2013, 34(8): 1347-1353.
36. O'BRIEN J T, FIRBANK M J, KRISHNAN M S, et al. White matter hyperintensities rather than lacunar infarcts are associated with depressive symptoms in older people: The LADIS study[J]. Am J Geriatr Psychiatry, 2006, 14(10): 834-841.
37. ALEXOPOULOS G S, MEYERS B S, YOUNG R C, et al. 'Vascular depression' hypothesis[J]. Arch Gen Psychiatry, 1997, 54(10): 915-922.
【引用格式】廖羽君,党超,坎迪耶·纳兰信德,等. 结构化认知康复治疗在新加坡脑卒中后认知功能障碍患者中的应用效果分析[J]. 中国神经精神疾病杂志,2024,50(4):193-199.
DOI:10.3969/j.issn.1002-0152.2024.04.001
作者:中国神经精神疾病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









学习
50
#脑血管病# #缺血性脑卒中# #认知功能# #脑卒中后认知功能障碍# #结构化认知康复治疗#
52