JAMA Oncol: Durvalumab在局部晚期或转移性尿路上皮癌中疗效如何?
2017-08-23 陶白 肿瘤资讯
一项1/2期开放研究的中期结果表明,铂治疗后局部晚期/转移性尿路上皮癌患者中,durvalumab具有良好的耐受性和抗肿瘤活性,这促成了durvalumab在美国的获批。然而,更长期的结果如何?伦敦大学玛丽皇后学院Barts癌症研究所癌症实验医学中心的Thomas Powles博士更新这一研究结果。8月17日,《JAMA Oncology》在线刊登。
一项1/2期开放研究的中期结果表明,铂治疗后局部晚期/转移性尿路上皮癌患者中,durvalumab具有良好的耐受性和抗肿瘤活性,这促成了durvalumab在美国的获批。然而,更长期的结果如何?伦敦大学玛丽皇后学院Barts癌症研究所癌症实验医学中心的Thomas Powles博士更新这一研究结果。8月17日,《JAMA Oncology》在线刊登。
背景和目的
4期尿路上皮癌(UC)化疗后疾病复发的患者,其结局通常较差,而最佳的二线化疗方案仍未确定。正因如此,耐受性较好且能为此类患者带来临床获益的治疗需求具有较大的缺口。
Durvalumab是一种选择性高亲和力的工程化人源IgG1单克隆抗体,可阻断PD-L1与PD-1(半数最大抑制浓度[IC50],0.1nM)和CD80(IC50,0.04nM)结合。正在进行的多中心1/2期开放研究,旨在评估durvalumab单药治疗在局部晚期/转移性UC中的安全性和抗肿瘤活性。该研究的中期分析纳入了61例UC患者,研究表明,durvalumab的耐受性良好,并具有抗肿瘤活性,尤其是PD-L1高表达(≥25%的肿瘤细胞或肿瘤浸润免疫细胞表达PD-L1)的患者,这促成该药被美国FDA批准。
此研究为该1/2期开放研究的结果更新。依据此结果,durvalumab获得了FDA生物制品许可申请的优先审查,用于铂治疗后局部晚期/转移性UC的治疗。此外,此研究也对其他实体肿瘤患者的安全性进行了评估。
方法
设计、设置和参与者:
研究对象为来自于9个国家60个地区的191例组织学或细胞学证实为局部晚期/转移性UC的成年患者,且这些患者的疾病进展。
干预:
患者每2周静脉注射10mg/kg的durvalumab,共持续12个月或直到出现疾病进展、开始另一种抗癌治疗或出现不可接受的毒性反应。
主要结局和测量:
首要终点为安全性和客观应答率(ORR)。其中,ORR是由对分组盲的独立中央审查成员根据实体肿瘤应答评估标准(RECIST)1.1版进行确定。
结果
UC队列患者的基线特征:
共191例局部晚期/转移性UC患者接受了治疗。截止到2016年10月24日,durvalumab的中位暴露时间为2.8个月(范围,0.4~12.5个月),中位随访时间为5.78个月(范围,0.4~25.9个月),44例(23.0%)患者在研究末期继续接受durvalumab治疗。
患者中位年龄为67.0岁,多数为男性(136例,71.2%)和白人(123例,71.1%)。所有患者都为4期UC,190例(99.5%)既往接受了抗癌治疗(182例接受了基于铂的治疗,95.3%)。总体来说,182例患者(95.3%)在接受基于铂的治疗或治疗后出现疾病进展。研究入组时,177例患者(92.7%)出现内脏转移,82例(42.9%)肝转移,14例(7.3%)淋巴结转移。98例患者(51.3%)PD-L1高表达,79例(41.4%)低表达或阴性表达,14例(7.3%)表达情况不明。
UC队列中的抗肿瘤活性:
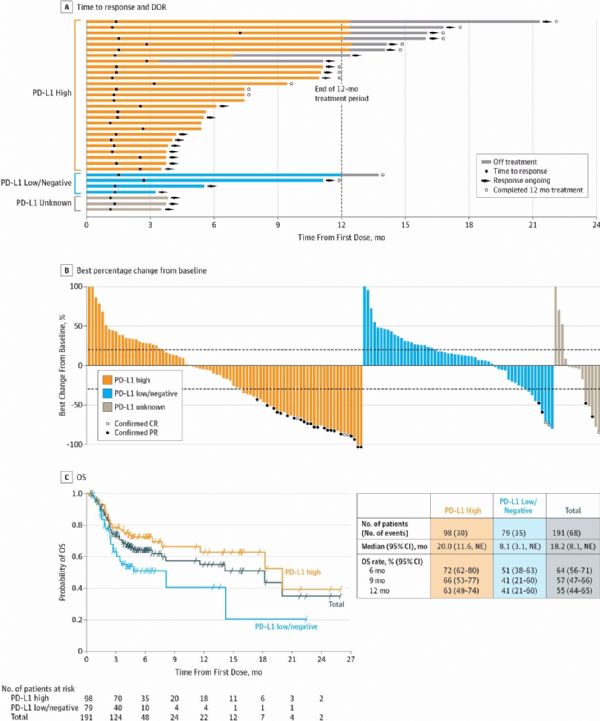
UC队列中,ORR为17.8%(34/191;95% CI,12.7%~24.0%),包括7例完全应答。应答特征为早期(发生应答的中位时间,1.41个月)、持久(中位应答持续时间未达到)、独立于PD-L1的表达状态:高表达和低/阴性表达患者中,ORR分别为27.6%(27例,95% CI,19.0%~37.5%)和5.1%(4例,95% CI,1.4%~12.5%)。不同PD-L1表达状态的患者间,完全应答率没有差异。
所有亚组都观察到了客观应答,包括预后较差者:内脏转移和肝转移的ORR分别为15.3%(27/177;95% CI,10.3%~21.4%)和7.3%(6/82;95% CI,2.7%~15.2%),淋巴结转移的ORR为50.0%(7/14;95% CI,23.0%~77.0%)。
UC队列的生存期:
由于随访期有限,因此数据截止时,OS数据并不成熟。中位PFS为1.5个月(95% CI,1.4~1.9),6、9和12个月的中位PFS率分别为22%(95% CI,16%~28%)、18%(95% CI,12%~25%)和16%(95% CI,10%~23%)。中位OS为18.2个月(95% CI,8.1~未评估)。6、9和12个月的中位OS率分别为64%(95% CI,56%~71%)、57%(95% CI,47%~66%)和55%(95% CI,44%~65%)。
UC队列中的安全性:
60.7%的患者出现任何级别的治疗相关不良事件(AE)。治疗相关AE的中位发病时间为6.1周(范围,4.1~10.1),第一个8周发病频率最高,32周左右进入平台期。最常见的AE为疲劳(19.4%)、食欲下降(9.4%)、皮疹(7.3%)。13例(6.8%)患者出现3/4级治疗相关AE。
4例(2.1%)患者出现3/4级免疫介导的AE。治疗相关的AE造成3例(1.6%)患者停药,其中的2例具有免疫介导的AE,并死亡(自身免疫性肝炎和肺炎)。
总体人群的安全性:
总体人群中,任何级别或3/4级治疗相关AE的类型和频率与UC患者相似,发病时间相似。
图:不同PD-L1表达状态的UC队列中,抗肿瘤活性和Kaplan-Meier总生存期分析
结论和意义
局部晚期/转移性UC患者中,每两周静脉注射10mg/kg的durvalumab具有良好的临床活性和令人鼓舞且可控的安全性特征。
点评
此研究将治疗限制在1年。虽然出现应答的患者在治疗1年后继续应答,但是这些患者是否需要继续治疗是未知的。因此,将来的研究应该将继续治疗和限制治疗进行比较,从而进一步理解继续治疗患者的应答状况。
此次分析得出的17.8%的ORR低于中期报道的31.0%的ORR,然而,在其他免疫治疗的研究中,也观察到ORR从一个临床开发阶段到下一个阶段出现降低。
交叉试验设计是此研究的一个主要混杂因素,然而,当与其他试验进行间接比较时,这些安全性结果是令人信服的。3/4级治疗相关AE发生率及其造成的停药率显示出超过其他药物的优越性。
此外,虽然AE和免疫介导的AE的发生频率已经被广泛报道,但是其发病时间还没有进行过详细的研究。此研究表明,第一个8周,发生频率最高,32周左右进入平台期。
基于研究结果,durvalumab将是化疗的替代选择,而不论生物标志物的状态如何。如今,已经有3项研究正在评估durvalumab作为单一治疗或与其他药物联合治疗的情况。因此,durvalumab正在由临床开发走向临床实践。
参考文献:
Powles T, O'Donnell PH, Massard C,et al.Efficacy and Safety of Durvalumab in Locally Advanced or Metastatic Urothelial Carcinoma: Updated Results From a Phase 1/2 Open-label Study.JAMA Oncol.doi: 10.1001/jamaoncol.2017.2411.
作者:陶白
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#Oncol#
34
#局部晚期#
37
#局部晚期或转移性尿路上皮癌#
45
#mAb#
37
#转移性#
35