Nature:警惕该益生菌,有引发DNA损伤从而增加癌症发生的风险
2024-11-16 Hanson临床科研 Hanson临床科研
益生菌受推崇,但研究发现某些大肠杆菌菌株可促结肠癌。介绍 Jans 等在 Nature 发表研究亮点,如揭示细菌与宿主细胞结合引发 DNA 损伤等,探讨其临床相关性、科研启发及相关评论文章。
前言:
近年来,包括某些大肠杆菌特定菌株在内的益生菌备受推崇,特别因其在调节免疫、抑制炎性反应中的作用而成为保健品中的明星。
但科学家们在研究肠道微生物与结肠癌发生关联的时候,也发现了这些益生菌可能在促进癌症方面起到作用。并发表在了顶级医学期刊Nature杂志。
结果显示:
-
某些细菌,尤其是大肠杆菌的特定菌株,通过其表面粘附蛋白与宿主细胞结合,能够促进基因毒性分子如colibactin的传递,从而引发DNA损伤并增加癌症发生的风险。
-
这一发现不仅深化了我们对肠道菌群在肿瘤形成中作用的理解,为未来开发预防和治疗结肠癌的新策略提供了潜在的研究方向;更对益生菌的应用提出了警告。

既往研究表明,细菌能够通过损伤宿主DNA并诱发癌基因的特定突变来促进结肠癌的发生。Jans等人的研究揭示了细菌黏附宿主细胞的过程,使某些菌株特别危险。这些发现为识别致癌细菌并制定预防策略提供了新的思路。
大肠杆菌是肠道中最常见且研究最为深入的细菌之一。
2006年的研究首次报道,特定的大肠杆菌菌株可以产生colibactin,这种分子能够损伤人类DNA。研究发现,这些菌株在患有结肠肿瘤或前期病变(可能发展为肿瘤)的人群中更为常见。
然而,并非所有产生colibactin的大肠杆菌菌株在引发突变方面的潜力都相同。例如,通常作为益生菌使用的大肠杆菌Nissle 1917(EcN)菌株导致的DNA损伤显著低于其他产colibactin的大肠杆菌菌株。
随着早发性结肠癌发病率的上升,理解哪些情况下某些产colibactin的大肠杆菌会影响人类基因组,以及是否能够预防这种基因毒性损伤,显得尤为重要。
Jans等发表于Nature的研究有以下亮点:
研究亮点一:
Jans等人的研究通过观察细菌与小鼠结肠表面细胞的结合,揭示了这一结合如何加剧colibactin引发的DNA损伤和癌症的发生。他们集中研究了使细菌附着到宿主细胞上的粘附素蛋白FimH和FmlH,并发现了大肠杆菌菌株之间的微妙差异。
尽管益生菌EcN菌株和与人类结肠癌相关的11G5菌株都产生相似水平的colibactin,仅仅在其FimH蛋白中存在的三个氨基酸残基差异,便导致了小鼠结肠癌模型中完全不同的结果。
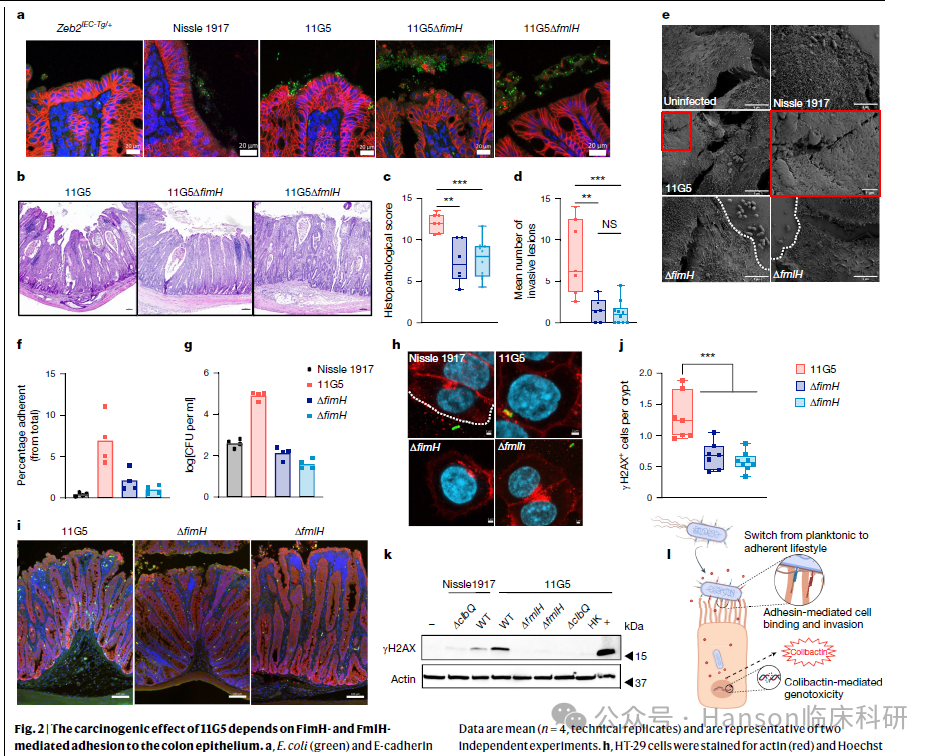
研究亮点二:
研究还展示了粘附素在人体细胞上的靶结构的分布,发现这些靶结构在肠道的特定细胞类型上有所富集。尽管大多数关于细菌侵入的实验是在均一的癌细胞体外样本上进行的,但使用更生理化的系统(如肠道类器官3D模型)进行后续研究,将有助于识别大肠杆菌附着和侵入宿主细胞的目标细胞。
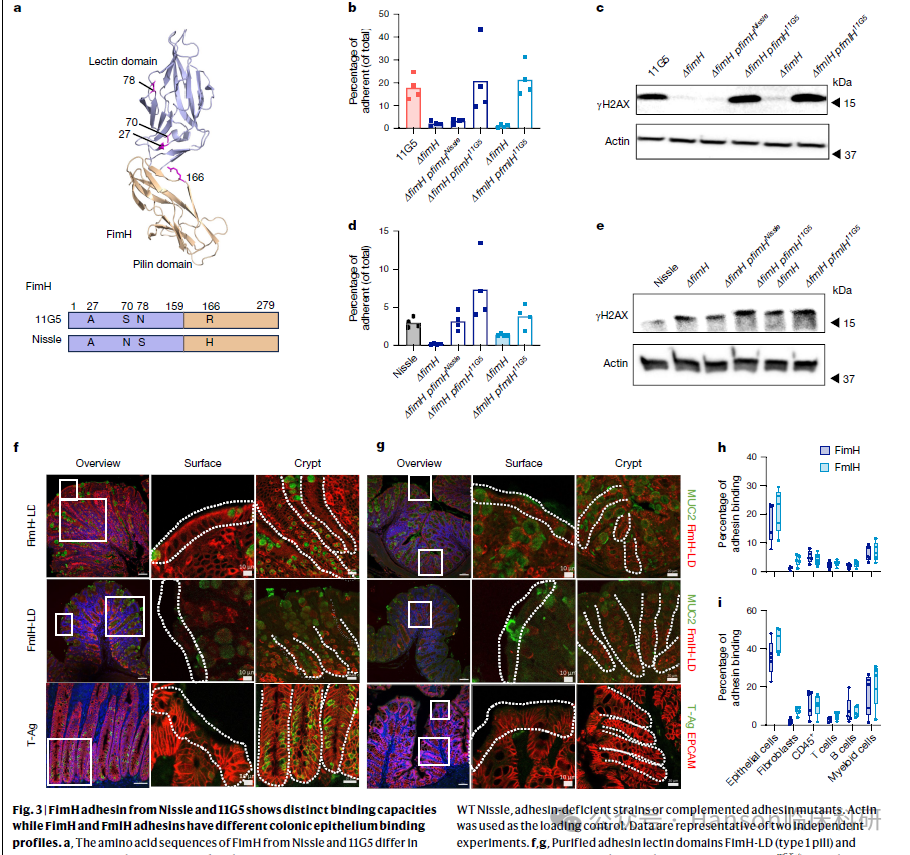
研究亮点三:
研究发现,细菌粘附FimH是colibactin介导基因毒性的重要前提,研究人员测试了一种已获临床批准的FimH抑制剂sibofimloc。令人惊讶的是,使用该化合物治疗后,11G5菌株的粘附和基因毒性活性被阻断,导致小鼠肿瘤形成显著减少。这一发现表明未来可能进行临床研究,探讨使用sibofimloc或其他针对细菌粘附的化合物来干扰依赖粘附的基因毒性细菌的作用。
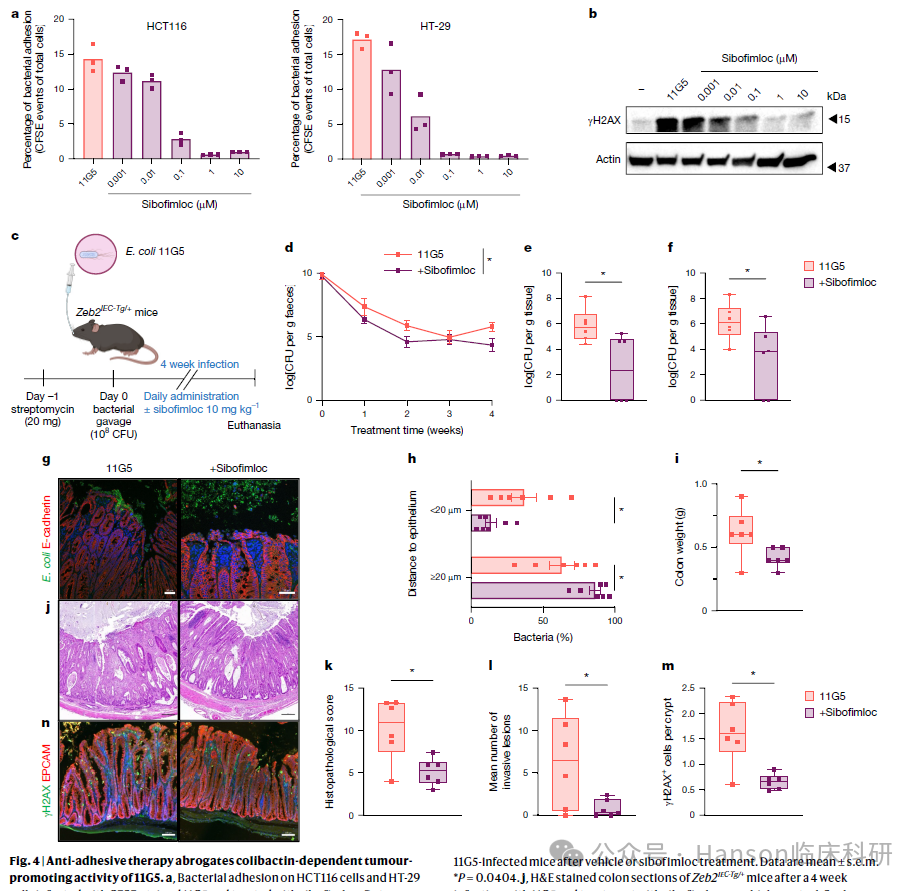
研究亮点四:
作者提出了一个值得进一步研究的有趣发现:在他们的小鼠模型中,仅由单一的基因毒性大肠杆菌菌株定植不足以强烈诱发肿瘤形成,而由复杂的肠道微生物群定植则会增强此类细菌的促肿瘤效应。考虑到先前的研究表明大肠杆菌如何与其他细菌物种(如特定的脆弱拟杆菌菌株)相互作用以接触结肠表面细胞,这一发现尤为引人注目。
编者按:
这项高质量的突破性研究,也迅速引发Nature编辑的特别关注,并在新闻和观点版面发表题为“Sticky situation: how adhesive bacteria drive colon cancer”(棘手的局面:粘附性细菌如何驱动结肠癌的发展)的评论文章,针对同期发表的文章探讨了细菌,尤其是大肠杆菌,与结肠癌发生之间的关系。
评述认为,Jans 等最新的研究揭示了某些菌株通过其表面粘附蛋白与宿主细胞的结合,如何在宿主体内引发DNA损伤和促进肿瘤的形成。
这一研究为理解肠道微生物在癌症发生中的作用提供了新的视角,并指出了潜在的预防和治疗途径。通过探索细菌黏附性与基因毒性之间的关联,为未来开发针对细菌粘附的治疗方法提供了新的策略选择。
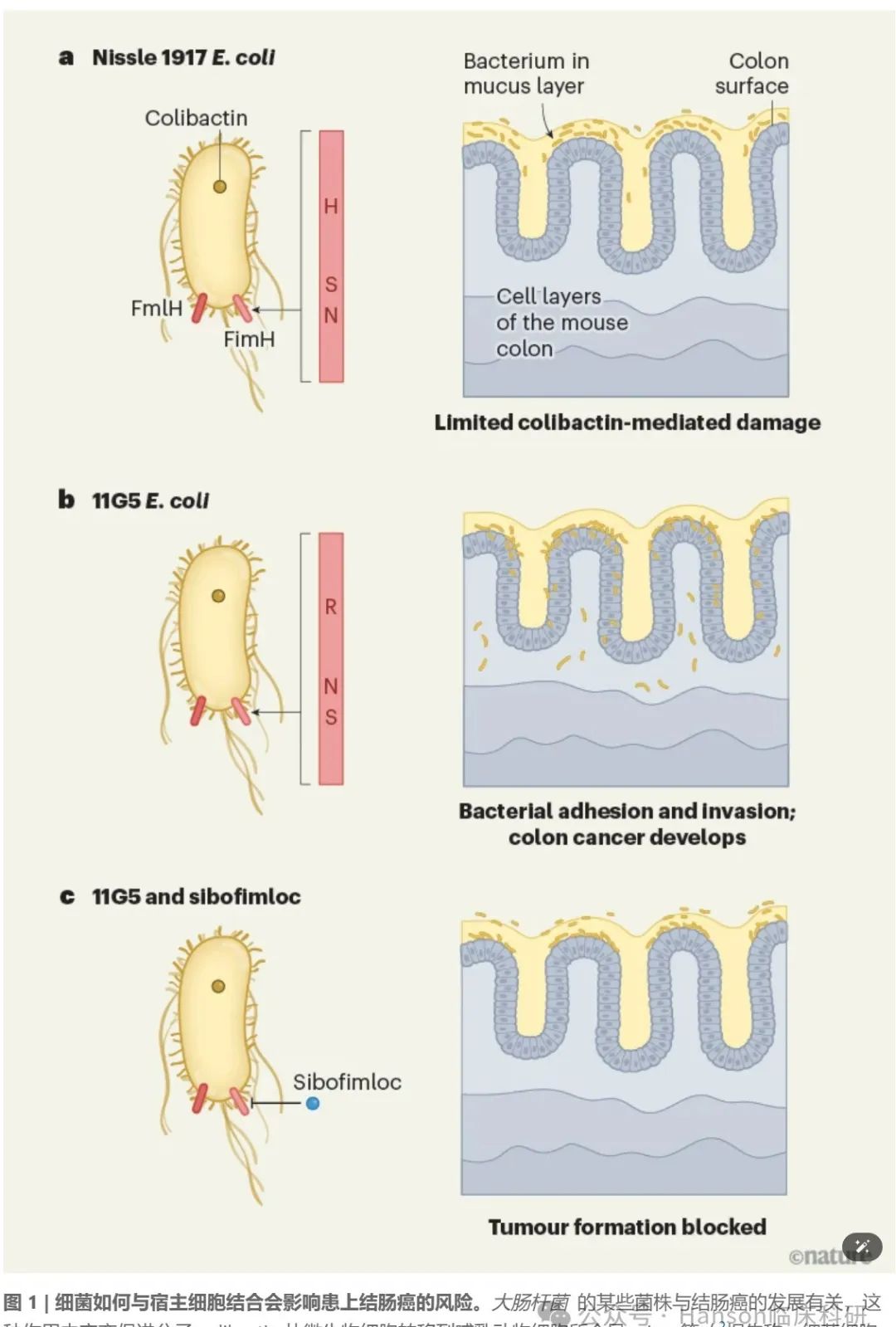
(不同菌株,致癌/抑癌作用差别显著)
临床相关性:
这项研究是评估益生菌EcN菌株基因毒性风险的重要一步。由于EcN的粘附素中仅有三个氨基酸残基的差异与其大幅降低的基因毒性活性有关,作者指出,EcN菌株可能通过突变或来自其他细菌的水平基因转移获得危险的粘附变异。这种情况会使任何产colibactin的菌株比以往更具基因毒性。
研究者也多次提到益生菌,本研究中展示,益生菌的某些菌株有促发结肠癌 风险,需要警惕。
尤其建议在读这篇论文的原文时,与下面的文章结合起来看。在充分利用肠道菌群,消除其潜在隐患尤为重要。
科研启发:
关于癌症中细菌基因毒性的研究不应局限于大肠杆菌。在患有炎症性肠病的人群中,研究显示大量细菌物种能够通过各种小分子和酶损伤DNA。
阐明细菌附着宿主细胞的原理如何适用于这些不同类别的细菌和基因毒素,将对全面解决由细菌驱动的突变问题至关重要。
随着肠道微生物与癌症之间联系的研究逐渐加快,癌症基因组分析、微生物学和流行病学数据的整合有望进一步加深我们对上述领域的认识,并推动益生菌安全性评估和针对肠道微生物进行癌症预防的临床开发。
参考文献:
Ouyang KS, Puschhof J. Sticky situation: how adhesive bacteria drive colon cancer. Nature. 2024 Nov 6. doi: 10.1038/d41586-024-03285-6. Epub ahead of print. PMID: 39506166.
Jans, M., Kolata, M., Blancke, G. et al. Colibactin-driven colon cancer requires adhesin-mediated epithelial binding. Nature (2024). https://doi.org/10.1038/s41586-024-08135-z
作者:Hanson临床科研
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#结肠癌# #癌症# #大肠杆菌#
31