引言
在癌症治疗领域中,研究人员不断揭示新的机制,以便更好地理解肿瘤如何规避治疗并迅速进化。近年来,染色体外DNA(extrachromosomal DNA, ecDNA)的发现为理解癌症的发生、进展及耐药机制提供了全新视角。ecDNA是存在于癌细胞中的独立于染色体的大型环状DNA分子,其在调控基因表达和维护基因组不稳定性方面具有重要作用。11月6日 Nature “Origins and impact of extrachromosomal DNA”深入探讨了ecDNA在癌症中的起源、特性及其临床意义。

染色体外DNA(ecDNA)的定义与特征
染色体外DNA是一种独立于染色体的环状DNA片段,通常携带关键的致癌基因(oncogenes)及其调控元件(如启动子和增强子)。这些ecDNA能够在癌细胞中通过随机分配进行遗传,这种不受控的遗传模式不同于染色体的稳定遗传方式,从而导致基因拷贝数的高度变化,进而加速癌症的进化与对治疗的抵抗。
在“十万基因组计划”(100,000 Genomes Project)中,研究者对14,778名癌症患者样本进行了分析,发现17.1%的肿瘤样本中存在ecDNA,并且这些ecDNA与肿瘤的组织类型、遗传背景及特定突变模式密切相关。不同癌症类型中ecDNA的检出率存在显著差异,例如,脂肪肉瘤(liposarcoma)中ecDNA的检出率为54.9%,在胶质母细胞瘤(glioblastoma)中为49.1%,而在HER2阳性乳腺癌(HER2+ BRCA)中为46.4%。某些癌症类型,例如低级别少突胶质细胞瘤(oligodendroglioma),几乎没有检测到ecDNA。这些差异反映了ecDNA在不同癌症类型中的频率及其与组织来源之间的关联性。
ecDNA的随机分配特性意味着其数量可以在细胞群体之间存在显著差异,从而为肿瘤提供更大的进化空间和适应性。尤其在治疗压力下,ecDNA的拷贝数变化可显著增加某些致癌基因的表达,帮助癌细胞在不利环境中存活。这种动态变化使得ecDNA成为癌细胞对抗外部干扰的有力工具。例如,MDM2和CDK4基因在脂肪肉瘤中表现出显著的ecDNA扩增,这种扩增与肿瘤的高侵袭性和治疗难度密切相关。
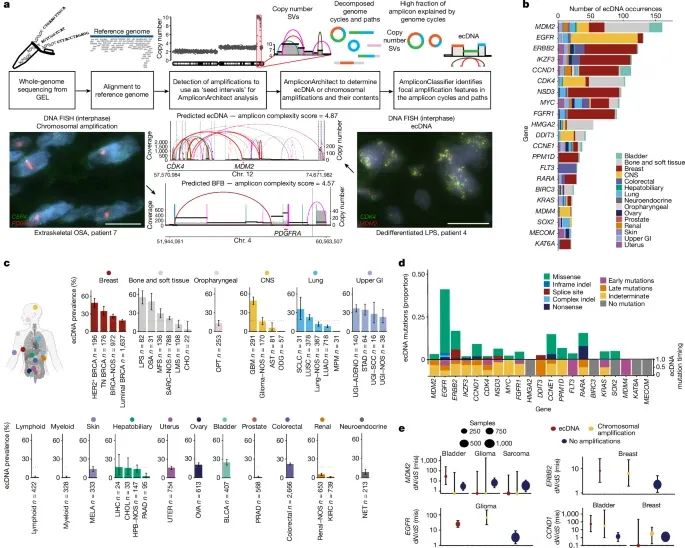
ecDNA在不同癌症类型中的发生频率、与不同基因相关的突变特征及其在不同组织中的特异性分布(Credit: Nature)
图a:展示了用于处理Genomics England(GEL)队列的分析流程,顶部是分析管线,底部为两个GEL患者的FISH(荧光原位杂交)图像和AmpliconArchitect结构变异视图。左侧的例子展示了与FISH图像一致的染色体扩增,而右侧的例子则展示了与FISH图像一致的染色体外DNA(ecDNA)。
图b:柱状图显示了携带致癌基因的ecDNA的发生次数,每个柱子的颜色表示不同组织类型中的病例数。
图c:展示了不同癌症类型中ecDNA的特异性分布。每个子Panel显示特定组织类型中的癌症中ecDNA的发生率,橙色虚线代表整个队列中的ecDNA驱动的扩增中位数,误差条表示95%置信区间。
图d:堆积柱状图显示了在ecDNA上观测到的致癌基因的非同义突变类型的比例(顶部)以及这些非同义突变在不同时间类别中的比例(底部)。仅显示了影响21个最常见致癌基因的突变。
图e:dN/dS分析比较了致癌基因在染色体扩增、ecDNA和无扩增区域中的突变情况。误差条表示使用dNdScv软件包计算的95%置信区间。
染色体外DNA的形成与癌症类型的关联
研究表明,ecDNA的形成与外部环境因素以及基因组内在的突变过程密切相关。例如,烟草暴露与同源重组修复缺陷(homologous recombination repair deficiency, HRD)等突变过程均与ecDNA的形成和肿瘤的进展有密切联系。不同类型的癌症中,ecDNA的分布存在显著差异。例如,脂肪肉瘤的ecDNA检出率为54.9%,而胶质母细胞瘤为49.1%。此外,HER2阳性乳腺癌和上消化道腺癌中ecDNA的检出频率较高,而在某些神经内分泌肿瘤中则相对罕见。
这些差异揭示了癌症类型的组织来源对ecDNA的组成和频率的显著影响。进一步研究显示,ecDNA可以由来自不同染色体的基因片段组成,这种现象在肉瘤和乳腺癌中尤其常见。这表明ecDNA的形成与基因组重排及不稳定性密切相关,可能是癌症进化过程中基因组复杂化的一种表现。
此外,ecDNA的形成还可能受到细胞周期紊乱的影响。在某些癌症中,细胞周期调控机制的缺陷导致DNA在复制过程中产生大量的基因组碎片,这些碎片通过非同源末端连接(NHEJ)等途径形成环状DNA,最终成为ecDNA。研究表明,这种过程在高基因组不稳定性的癌症类型中尤为常见,例如胶质母细胞瘤和卵巢癌。
染色体外DNA的功能和作用机制
ecDNA的存在使得癌细胞在基因组层面具备了更高的异质性和灵活性,这为肿瘤的进化提供了显著的选择优势。首先,ecDNA中的致癌基因拷贝数通常远高于染色体上的拷贝数,这意味着这些基因的表达量显著增加,从而大幅增强致癌信号。例如,FGFR2、MDM2和CDK4等基因在ecDNA中的扩增远高于它们在染色体中的水平。
其次,ecDNA的环状结构使其能够在细胞核内形成“基因组中心”,通过与其他基因调控元件的相互作用,增强致癌基因的转录活性。这些“基因组中心”可以介导增强子(enhancer)与启动子(promoter)之间的远距离相互作用,从而大幅增加基因表达的复杂性和调控能力。
这一机制尤其在某些高度依赖特定信号通路的癌症中显得尤为重要。例如,在胶质母细胞瘤中,ecDNA携带的EGFR基因通过与多个增强子区域的互作,显著增加了EGFR的表达水平。这种表达的增加直接与癌细胞的增殖速度及侵袭能力相关,使得肿瘤具有更强的恶性特征。
除致癌基因扩增外,ecDNA还经常携带与免疫系统相关的调控基因。这些免疫调节基因的扩增可能会抑制肿瘤微环境中的T细胞浸润,使得携带这些基因的肿瘤更加难以被免疫系统识别和消除。在一项分析中,携带免疫调节基因的ecDNA与较低的肿瘤T细胞比例相关,这表明这些基因可能通过免疫抑制机制帮助癌细胞逃避免疫监视。
此外,ecDNA可以促进肿瘤异质性。由于ecDNA在细胞分裂时随机分配,这种不对称的分布导致肿瘤内部的基因表达呈现出显著的差异性,从而增加了肿瘤的异质性。这种异质性为肿瘤在面对不同治疗策略时提供了多种适应路径,使得部分细胞群体能够在治疗压力下存活并继续扩展。
临床意义:ecDNA对癌症治疗的影响
ecDNA的存在与癌症的恶性程度及不良预后密切相关。研究表明,携带ecDNA的肿瘤通常处于更高的分期(如IV期),且更容易发生远处转移。此外,ecDNA的存在与化疗和靶向治疗后的耐药性增加显著相关,表明ecDNA可能通过快速基因组重排来促进肿瘤对治疗的抵抗。
对于接受化疗或靶向治疗的患者,ecDNA的检测率显著升高,这提示ecDNA可能是癌细胞应对治疗压力的一种重要适应机制。在一项针对胶质母细胞瘤患者的研究中,研究者发现,在接受TMZ(temozolomide)治疗后,某些携带EGFR突变的ecDNA显著增加,并且这些突变与治疗后产生的高突变频率相关。这表明抗癌药物可能通过诱导基因突变加速ecDNA的进化,使癌细胞更具侵袭性和治疗抵抗性。
此外,ecDNA的存在还可能对免疫治疗的效果产生影响。携带ecDNA的肿瘤细胞通过扩增免疫抑制基因,降低了T细胞和其他免疫细胞的活性,从而削弱了免疫治疗的效果。在某些情况下,肿瘤中的ecDNA数量越多,患者对免疫检查点抑制剂的反应越差,这进一步凸显了ecDNA在肿瘤免疫逃逸中的作用。
染色体外DNA的未来研究方向和治疗策略
ecDNA在癌症中的关键作用使其成为一个具有重要潜力的治疗靶点。由于ecDNA独立于染色体,其在细胞分裂中的随机分配导致基因组的不稳定性,这一特性使得ecDNA成为靶向治疗的理想候选对象。未来的研究可能会集中于开发能够特异性识别和降解ecDNA的药物,或者干扰ecDNA形成和维持的关键分子机制。
目前,一些研究正在探索通过抑制ecDNA复制或干扰其在细胞中的分配来阻止癌细胞的生长。例如,靶向ecDNA复制的药物可能会导致ecDNA无法维持其在细胞中的拷贝数,从而降低致癌基因的表达水平。此外,研究人员还在探索是否可以通过增强细胞的DNA修复能力来减少ecDNA的形成,从而减少其对癌细胞进化的贡献。
此外,理解ecDNA的形成和进化过程对于制定个性化的癌症治疗方案至关重要。例如,对于一些高频率携带ecDNA的癌症类型,ecDNA可能作为预测患者预后的生物标志物,从而帮助临床医生制定更加精确的治疗策略。通过监测ecDNA的变化,医生可以更好地判断治疗效果,并在必要时调整治疗方案,以应对癌细胞的进化和耐药性。
参考文献
Bailey C, Pich O, Thol K, Watkins TBK, Luebeck J, Rowan A, Stavrou G, Weiser NE, Dameracharla B, Bentham R, Lu WT, Kittel J, Yang SYC, Howitt BE, Sharma N, Litovchenko M, Salgado R, Hung KL, Cornish AJ, Moore DA, Houlston RS, Bafna V, Chang HY, Nik-Zainal S, Kanu N, McGranahan N; Genomics England Consortium; Flanagan AM, Mischel PS, Jamal-Hanjani M, Swanton C. Origins and impact of extrachromosomal DNA. Nature. 2024 Nov;635(8037):193-200. doi: 10.1038/s41586-024-08107-3. Epub 2024 Nov 6. PMID: 39506150.
作者:生物探索
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#癌症# #ecDNA#
32