【Blood】T-ALL的临床特征、基因组学及风险分层
2024-10-25 聊聊血液 聊聊血液
《Blood》近日发表综述,总结了 T-ALL 的临床和生物学分类,强调了确定可靠预后生物标志物方面的进展,并强调了基于基因组学的分类在指导未来 T-ALL 治疗策略的潜力。
T-ALL
近几十年来,急性淋巴细胞白血病 (ALL) 患者的治愈率显著提高,部分原因在于风险分层整合了白血病基因组学、治疗反应和临床特征,能够在诊断时确定哪些患者更可能复发或患有难治性疾病。高危患者更容易复发或患有难治性 (r/r) 疾病,可以接受更强化或替代治疗,包括免疫治疗和精准治疗;低危患者具有较高的治愈率,可能适合参加探索减少治疗以减轻毒性的临床试验。
虽然 B 系 ALL(B-ALL) 患者的风险分层发展良好,但 T 系 ALL(T-ALL) 患者仍具有挑战性。在 T-ALL中已验证的预后因素包括年龄、中枢神经系统 (CNS) 受累和微小残留病 (MRD) 缓解;包括早期 T 细胞前体 (ETP) ALL 的免疫表型广泛用于 T-ALL 分类,但在多因素风险模型中并不始终与结局相关。历史上很少有基因改变始终与结局相关,但最近全面、大规模的基因组分析已确定与结局相关的多种基因亚型和改变(独立于MRD)。
《Blood》近日发表综述,总结了 T-ALL 的临床和生物学分类,强调了确定可靠预后生物标志物方面的进展,并强调了基于基因组学的分类在指导未来 T-ALL 治疗策略的潜力。
人口统计学和流行病学
ALL 是最常见的儿童肿瘤。T-ALL占儿童 ALL 病例的10-15%,占成人 ALL 病例的10-25%。B-ALL最常见于幼儿,而 T-ALL 常出现于大龄儿童、青少年和年轻人。T-ALL在男性(约70%的病例)中也比女性更常见。男性中的频率增加部分与位于 X 染色体上的基因(如PHF6、MED12、STAG2、USP9X、RPL10、KDM6A、DDX3X、BCOR)频繁改变相关。
在美国,B-ALL更常见于白人儿童,而 T-ALL 更常见于黑人或非裔美国人。来自儿童肿瘤组 (COG) 的数据发现,黑人或非裔美国人的 B-ALL 儿童、青少年和年轻成人 (AYA) 与西班牙裔儿童和 AYA 存在显著的结局差异,而在基于人种的 T-ALL 中未观察到生存期差异。这种差异相当显著,因为 B-ALL 和 T-ALL 的治疗方案相似,且患者是在同一时代和同一机构接受治疗。T-ALL患者的复发倾向于早于 B-ALL 患者,表明与 B-ALL 相比,T-ALL患者更早接受更强化治疗可能对治愈更为重要。与之相反,更早的复发可能与 T-ALL 对抗代谢物为基础维持化疗的耐药相关,相关证据为,复发的主要机制涉及对化疗耐药基因(如NT5C2)发生基因改变的原始细胞进行克隆选择。因此,维持治疗期间依从性的差异可能不会对 T-ALL 的结局产生与 B-ALL 相同程度的影响。
临床特征
历史上,各种临床特征,如纵隔肿块、CNS受累、外周血WBC、血红蛋白、血小板计数、年龄和诊断时脾肿大均曾用于 T-ALL 风险分层,而现代 T-ALL 风险分层已纳入MRD 缓解,只有年龄和 CNS 受累仍是各治疗方案的独立预后因素。诊断时的年龄是 B 和 T-ALL 结局的强预测因素,无论白血病类型如何,<1岁婴儿的结局均较差;尽管 T-ALL 在婴儿中罕见且数据有限。在 B-ALL 中,10岁及以上的患者预后更差,生存率几乎随着年龄的增加呈线性下降。B-ALL中最近的风险分层算法将年龄作为连续变量,而非分为几个离散的组。在 T-ALL 中,虽然幼儿和老年人的生存率存在明显差异,但年龄在预测结局方面并不如 B-ALL那般稳健。在最近针对 T-ALL 患者的两项 COG 3 期研究 AALL0434(NCT00408005) 和 AALL1231(NCT02112916) 中, 1-30岁的儿童和 AYA 患者结局相同。但其他队列报告中不同年龄组的结局存在差异。
诊断时外周血白细胞计数 (WBC) 也与 ALL 的结局相关。尽管 WBC 与生存期呈逆线性关系,但在风险分层中通常二分性。在 B-ALL 中,患者通常分为高危组和低危组(使用50000/ml的cutoff值)。在 T-ALL 中,诊断时 WBC 的预后影响不太稳健,许多协作组不再使用WBC纳入风险分层。然而,在 COG AALL0434 研究中,已报告极高WBC(>200000/μl) 与非ETP T-ALL儿童的较差生存期相关。早期数据表明 WBC> 100000/μl患者可能预后较差。
诊断时的 CNS 状态与预后具有相关性。许多联盟将患者分为三组:(a)CNS-1(细胞离心涂片无原始细胞),(b)CNS-2(CSF WBC原始细胞<5/ml)和 (c)CNS-3(CSF WBC原始细胞≥5/ml)。创伤性腰椎穿刺 (TLP) 的方法各不相同:部分工作组使用 Steinherz-Bleyer 公式来确定 CNS 状态,而其他小组将 TLP 视为一个独立的小组。在 B-ALL 中,与 CNS-1 患者相比,CNS-2、CNS-3和 TLP 患者的预后更差。在 T-ALL 中,尽管 CNS-3 可预示强化治疗下预后较差,但 CNS-2 的影响因治疗方案和确定 CNS 疾病的技术而异;例如,接受 AALL0434 和 AALL1231 治疗的 T-ALL 患者在 CNS-1 和 CNS-2 之间的结局没有差异,而在医学研究委员会 (MRC) 研究中,UKALL2003和 UKALL2011 CNS-2 的结局与 CNS-3 相似,但比 CNS-1 更差。
免疫表型
T-ALL 可根据免疫表型和原始细胞成熟阶段进行分类。欧洲白血病免疫表型分析工作组 (EGIL) 将 T-ALL 分为4组:pro-T ALL(胞质,表面CD3 +[cCD3 +,sCD3-],CD1a-,CD2 +,CD5-,CD7 +),pre-T/immature ALL(cCD3 +,sCD3-,CD1a-,CD2 +,CD5 +,CD7 +),皮质T-ALL(cCD3 +,sCD3 +/-,CD1a +,CD2 +,CD5 +,CD7 +)和成熟T-ALL(cCD3 +、sCD3 +、CD1a-、CD2 +、CD5 +、CD7 +)。在单因素分析中,部分研究显示基于 EGIL 分类的生存期存在差异,其中皮质 T-ALL 的结局最佳;然而在多因素分析中,一旦与治疗反应整合,EGIL分类并不保留预后意义。皮质病例显示细胞周期调节和 DNA 复制相关基因的表达较高,可作为当前治疗的靶点。
2009年,Coustan-Smith等描述了早期 T 细胞前体 (ETP)ALL,定义为 T 细胞标志物阳性,包括CD2、cCD3和CD7,无 CD1a 和 CD8 表达,CD5表达缺失或弱阳性(与正常 T 细胞相比 <75%),至少一种髓系或干细胞标志物为阳性(HLA-DR、CD13、CD33、CD34或CD117)。Near- ETP T-ALL 病例具有相似的免疫表型,但 CD5 高表达。Coustan-Smith的初步报告称,在 St Jude 和 AEIOP 研究中接受治疗的 ETP ALL 的预后较差,但最近的研究表明ETP ALL患者的生存率与非 ETP T-ALL 患者相当。ETP ALL更容易对皮质类固醇耐药,且早期 MRD 反应较差。因此,由于 ETP 患者对治疗的反应通常较慢,并且在诱导结束时 MRD 的发生率较高,通常对其进行风险分层以接受更强化的治疗,例如更高剂量的环磷酰胺。虽然 ETP 和非 ETP ALL 患者的无事件生存期 (EFS) 和总生存期 (OS) 相似,但事件类型不同:ETP ALL患者更可能患有难治性疾病,而非 ETP ALL 患者更可能复发。
治疗反应
治疗反应是 T-ALL 结局的最强预测因素,也是临床试验多因素分析中均显著的唯一预后因素。极早期治疗反应已在部分研究中证明与 T-ALL 的结局相关,但在其他研究中未保留独立预后意义。Berlin-Frankfurt-Münster(BFM)等协作组在一线使用泼尼松开始 T-ALL 治疗,使用单次鞘内甲氨蝶呤和一周泼尼松治疗。前期治疗后血液原始细胞 <1.0x109/L的患者称为泼尼松良好应答者 (PGR),血液原始细胞水平较高的患者被称为泼尼松应答不良者 (PPR)。BFM和其他组显示,与 PPR 相比,PGR的 T-ALL 患者的 EFS 和 OS 改善。与之不同,COG发现诱导第8天的早期外周血 (PB)MRD 反应在单因素分析中具有预后价值,但当考虑诱导结束骨髓 MRD 时,其在多因素分析中不再具有显著性。
几项大型研究使用流式或 PCR 技术研究了不同治疗方案下不同时间点骨髓 MRD 的预后效用。虽然大多数数据表明诱导结束MRD(时间点1,TP1)评估是 B-ALL 结局的最佳预测因素,但 AIEOP-BFM ALL 2000 的数据确定,巩固结束 (EOC) MRD(时间点2,TP2)是 T-ALL 不良结局的更好预测因素(使用分子技术检测MRD)。在初始诱导治疗后进行巩固治疗,一些协作组称为方案IB,通常是在约2个月内进行的两个治疗区组。EOC MRD在完成巩固阶段后评估 MRD 水平。其他协作组使用基于流式细胞术的 MRD 也显示类似结果。虽然 EOC MRD 可以确定一个非常差的风险组,需要造血干细胞移植治愈,但在 EOC 很少有患者持续MRD阳性;在 AALL1231研究中,使用0.1%的阈值来定义 EOC 时的 MRD 阳性,仅有不到5%的患者为 MRD 阳性。虽然这些患者的预后非常差,但大多数事件发生在 EOC 时 MRD 阴性的患者中,因此诱导结束(第29天)MRD对于风险分层仍是必需的。
诱导治疗无效的 T-ALL 患者预后较差。诱导失败 (IF) 因协作组的不同而不同,部分协作组根据骨髓原始细胞百分比(形态学评估)定义,也有基于MRD的,或同时使用这两种方法。此外也有协作组将 IF 定义为诱导后骨髓原始细胞≥25%,而其他协作组使用5%的阈值。无论定义如何,诱导失败的 T-ALL 患者始终表现出较差的预后。然而尚不清楚当 EOC MRD 纳入风险分层时,IF是否仍保留预后意义。现将 T-ALL伴 IF 的基因组特征介绍如下。
生物学和基因组学
WHO区分了 ETP-ALL 和分化程度较高的T-ALL。ICC则分为3个亚型:ETP-ALL,BCL11B活化;ETP-ALL,非特指型 (NOS);T-ALL,NOS;以及8个临时亚型:TAL1/2-重排、TLX1重排、TLX3重排、HOXA失调、LMO1/2-重排、NKX2-1重排、SPI1-重排和BHLH(basic-helix-loop-helix)和其他(表1)。
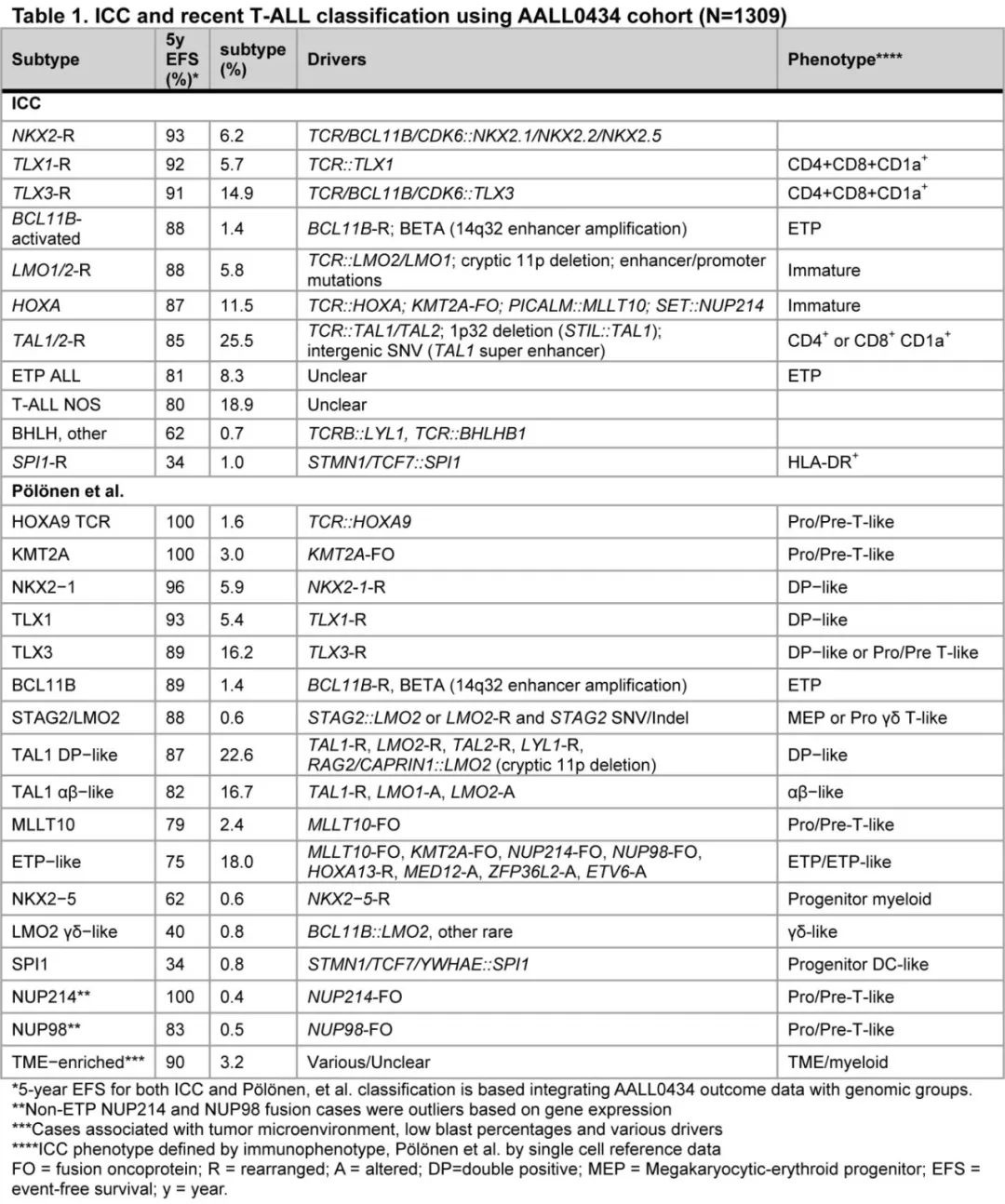
由于缺乏确定的临床相关性,WHO尚未定义 T-ALL 的基因亚型,而 ICC 的临时亚型不同程度地使用免疫表型和基因组特征来定义各组,但这些特征可能在某些亚型中重叠,此外这些亚型的临床意义尚不明确(图1A-B)。
基因表达研究已确定T-ALL 的关键癌基因和主要分组。基于 T-ALL 基因表达的亚型包括 TAL1/TAL2/LMO1/LMO2/LYL1 驱动的白血病的两个亚组,以及TLX1-、TLX3-、NKX2-1-和 HOXA9-活化亚型,还发现了其他遗传亚型,包括 SPI1 重排、HOXA13活化、BCL11B活化和 STAG2/LMO2 驱动的白血病。T-ALL转录因子癌基因通常通过染色体易位或增强子改变激活,最常见的机制包括劫持 T 细胞受体 (TCR) 增强子激活TAL1、LMO1、LMO2、TLX1、NKX2-1、HOXA9和TLX3,劫持 BCL11B 增强子激活 TLX3。另一个重要类别涉及调控区非编码改变,包括 TAL1 新增强子形成、LMO1增强子突变和 LMO2 新生启动子生成。
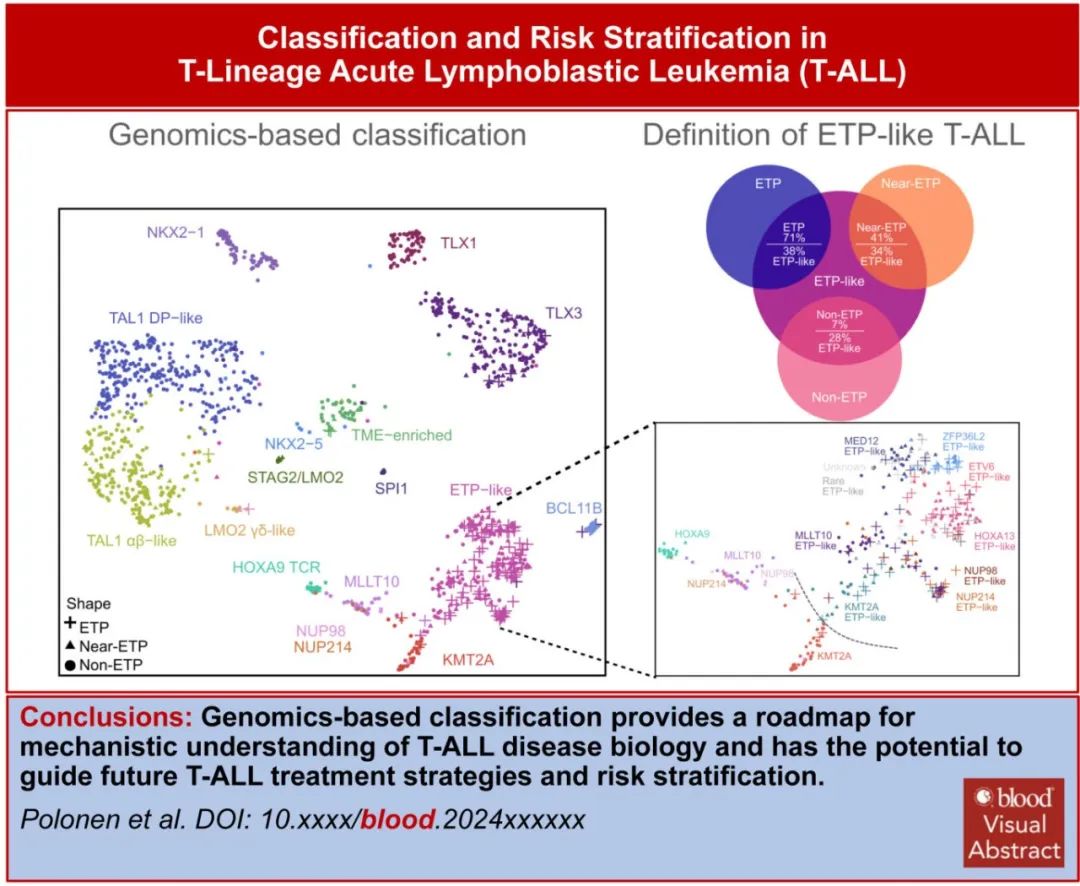
最近,通过基因表达和基因改变为基础的分类改善了 T-ALL 分类,该研究使用接受全基因组 (WGS)、全外显子组 (WES)、全转录组测序 (WTS) 的1309例儿童和年轻成人病例,确定了15种具有不同基因表达和发育阶段的 T-ALL 亚型(图1C,表1),并在95%的病例中确定了遗传驱动因素。值得注意的是,疾病分类中59%的驱动改变位于基因组的非编码区。这些数据强调了 WGS 对于识别所有驱动改变的重要性。此外,该研究根据驱动因素、共病变和/或分化阶段定义,进一步将 ETP 样、TLX3、NKX2-1和 TAL1 亚型分为其他遗传亚组,(图1D)。利用正常祖细胞的单细胞 RNA 测序数据集推断各亚型的造血或 T 系祖细胞分化阶段,有利于分类学分类(表1)。值得注意的是,在TAL1、TLX3的一个子集中观察到 ETP ALL 免疫表型病例,其中最常见的是一个独特亚组(基于基因表达),其包括71%的 ETP ALL 病例,但也包括41%具有近 ETP 免疫表型的病例和一小部分具有非 ETP 免疫表型的病例 (~7%)。该研究提出, ETP ALL 的(免疫表型定义)亚型应被更广泛类别的“ETP样”白血病所取代,后者由其基因表达谱和异质性驱动改变定义(图2)。
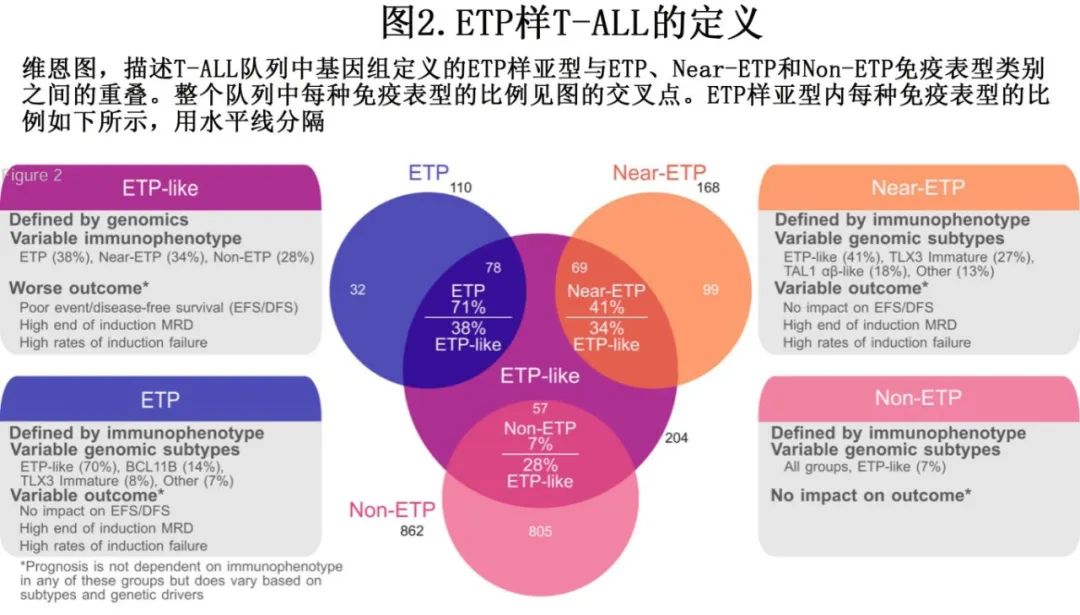
ETP样 ALL 的一个标志为编码已知或假定造血干细胞调节因子的基因的驱动改变,包括MLLT10、KMT2A、NUP98和 NUP214 融合(HOXA9调节因子)、HOXA13活化、ZFP36L2、ETV6和 MED12 改变(图1D)。在该基因组定义的 ETP 样组中,ETP、near-ETP 或non-ETP免疫表型病例之间的驱动频率或结局无显著差异。此外,BCL11B活化亚型中几乎所有病例均为 ETP 免疫表型。此外,免疫表型可将一部分 TLX3 重排病例归类为ETP或Near-ETP 。基于这些结果可以得出结论,T-ALL的免疫表型分类的表现不佳。此外ETP 样亚型与分化程度较高的 MLLT10/KMT2A 和 HOXA9 TCR 亚型(先前归为 HOXA 失调 T-ALL)不同(表1,图1D)。尽管在两种亚型中均观察到 KMT2A 和 MLLT10 重排和 HOXA9 表达,但基因表达谱、分化阶段、伴随基因改变模式和结局不同。在早期研究中,Ferrando等和 Soulier 等定义了未成熟白血病,定义为通过微阵列分析高表达LYL1、LMO2、CD34和 KIT 以及骨髓标志物的表面表达。尽管该组包括许多 ETP 样病例,但也包括 BCL11B 和 KMT2A 亚型。BCL11B和 KMT2A 的最新基因组数据支持将其分类为不同的亚型,因为它们在共同病变、基因表达谱和临床结局方面不同于 ETP 样亚型。因此,基因表达和 WGS 分析能够将 T-ALL 分类为由不同的致癌驱动因素、共同病变和分化阶段所定义的生物学不同亚型。
T-ALL 的其他遗传学改变主要为影响关键通路的序列突变和 DNA 拷贝数改变(图1E),包括可靶向信号通路中的改变,包括NOTCH(NOTCH1和FBXW7)、JAK-STAT(IL7R、JAK1、JAK3、STAT5B、FLT3、PTPN2、SH2B3和PRLR)、PI3K-AKT(PIK3CA、PIK3CD、PIK3R1、PTEN和MTOR)、Ras(NRAS和KRAS)和其他信号(ABL1融合癌蛋白)。还包括表观遗传学调控因子(PHF6、SUZ12、EZH2、KAT6A、USP7、SMARCA4、ASXL1、NSD1和KDM6A);转录调控因子 (MYC、MYB、MYCN、PSIP1);造血转录调控因子 (LEF1、WT1、BCL11B、ETV6、RUNX1、GATA3、IKZF1、TCF7、ERG) 和参与 mRNA 成熟和核糖体活性的基因 (RPL10、RPL5、RPL22);细胞周期 (CDKN2A、CCND3、RB1),黏连蛋白 (CTCF,STAG2) 和蛋白修饰 (USP9X,CUL1)。利用 WGS 和 WTS 数据的综合分析可确定靶向这些关键通路的其他非编码改变和基因内结构变异 (SV);举例说明,内含子 NOTCH1 单核苷酸变异 (SNV) 和基因内缺失或SV可通过改变胞外域蛋白结构导致 NOTCH1 活化。NOTCH1活化与有利预后相关,但这项研究发现内含子 NOTCH1 SNVs 和基因内缺失的结局更差,表明 WGS 是准确检测和分类所有变异的必要条件,对结局预测具有重要意义。在TCR::MYC和 PTEN 缺失中观察到与较差结局相关的相似模式。相比之下,MYC增强子增加和其他 PI3K 通路改变与更有利的结局相关。
复发和难治性疾病
O’Connor等和Po lo nen等开展的近期研究探索了 IF 的基因组学。O’Connor等使用 WGS 对46例 IF 病例进行分析,发现10种启动驱动因素,表明缺乏诱导失败的统一遗传驱动因素。该研究还注意到,约50%的病例为 ETP 免疫表型。Po lo nen等的结果研究表明,ETP样和LMO2γδ样基因表达为基础的亚型可解释79%的 IF 病例。
比较诊断和复发对的基因分析揭示了 T-ALL 的关键复发机制。Oshima等使用WES 和WGS开展了一项纳入46例 T-ALL 病例的研究,Richter-Pechańska等分析了38例 T-ALL 患者在诊断和复发时的 WES 数据,还有涵盖 B-ALL 和少数 T-ALL 病例的其他研究。值得注意的是,遗传学 T-ALL 复发机制与 B-ALL 基本相同。大多数 T-ALL 复发时仍保留初诊的初始分类驱动病变,但也有显著例外情况,包括与原发性白血病无关的治疗相关继发性恶性肿瘤。然而,即使对于看似不相关的癌症,在祖克隆中检测到共享突变也可提示共同的疾病起源。同样,O’Connor等证实晚期复发病例在子宫内就获得具有 LMO2 非编码突变的共同祖克隆。驱动 T-ALL 复发的最常见突变为核糖核酸酶 NT5C2 激活,其促进化疗耐药,见于20%的病例。复发中富集的其他常见突变包括RAS 激活突变(约23%)和TP53(约8%)。约8%的复发中观察到超突变表型,突变特征提示 DNA 错配修复缺陷或微卫星不稳定肿瘤。另有约8%的患者在诊断时保留相同的突变,但在复发时未获得额外突变。诊断时较罕见的亚克隆可在复发时呈优势克隆,包括NOTCH1、RAS和 CREBBP 突变的次要克隆扩增,证实克隆演变在复发中的重要性。研究还记录了诊断时的多个克隆持续存在和复发时表现出多克隆演变。谱系转换是 B 和 T-ALL 复发中记录的另一个关键问题,如 SPI1 第二肿瘤或其他 T-ALL 向骨髓谱系转变,从而强调了基因组分析在解释诊断和复发样本之间的关联中的重要性。总之,复发或难治性疾病的风险受以下因素的影响:亚型和驱动病变、诊断时确定的关键通路突变、复发时出现亚克隆突变和获得新突变。
T-ALL的风险分层
由于多种原因,在确定独立于T-ALL 治疗反应的、可重复预后的基因组改变方面进展有限。首先,尽管多项小型研究已经确定了基因组非编码区的改变,但很少有病例使用WGS,因此妨碍了对基因组驱动因子的全面鉴定。其次,尚无足够大的研究来确定独立于治疗反应的预后基因改变。第三,在一些研究中排除 IF 病例,从而妨碍了全面发现与 IF 相关的遗传驱动因素。最后,免疫表型定义的 ETP-ALL 被认为属于高危,并在风险分层中独立考虑,但结局相关性尚不清楚。
Po lo nen 等开展的研究确定了多个基因组亚型的预后且独立于MRD,ETP样亚组与诱导结束时 MRD 阳性相关,并且通常与较差结局相关(表2,图1F)。免疫表型(ETP、near-ETP、non-ETP)在 ETP 样亚型中无预后意义。与之相反,尽管高度富集ETP表型,但基因组上不同的 BCL11B 活化亚型表现出相对有利的结局。不在 ETP 样亚型内的 KMT2A 重排病例在诱导结束时 MRD 反应较差,但预后良好,而ETP样亚型内的 KMT2A 重排病例 MRD 反应较差、EFS较差。ZFP36L2 ETP样亚组显示 MRD 发生率较高,但预后良好。Xu等开展的最新数据使用 scRNA-seq 和 scATAC-seq 对40例 T-ALL 病例进行分析,揭示了骨髓祖细胞样(BMP样)特征,可识别耐药细胞类型,并可作为 T-ALL 风险分层的工具。这种 BMP 样标记在 ETP 样亚型中显著富集,而在 NOTCH1 突变的肿瘤中明显缺失,通常与更良好的预后相关。
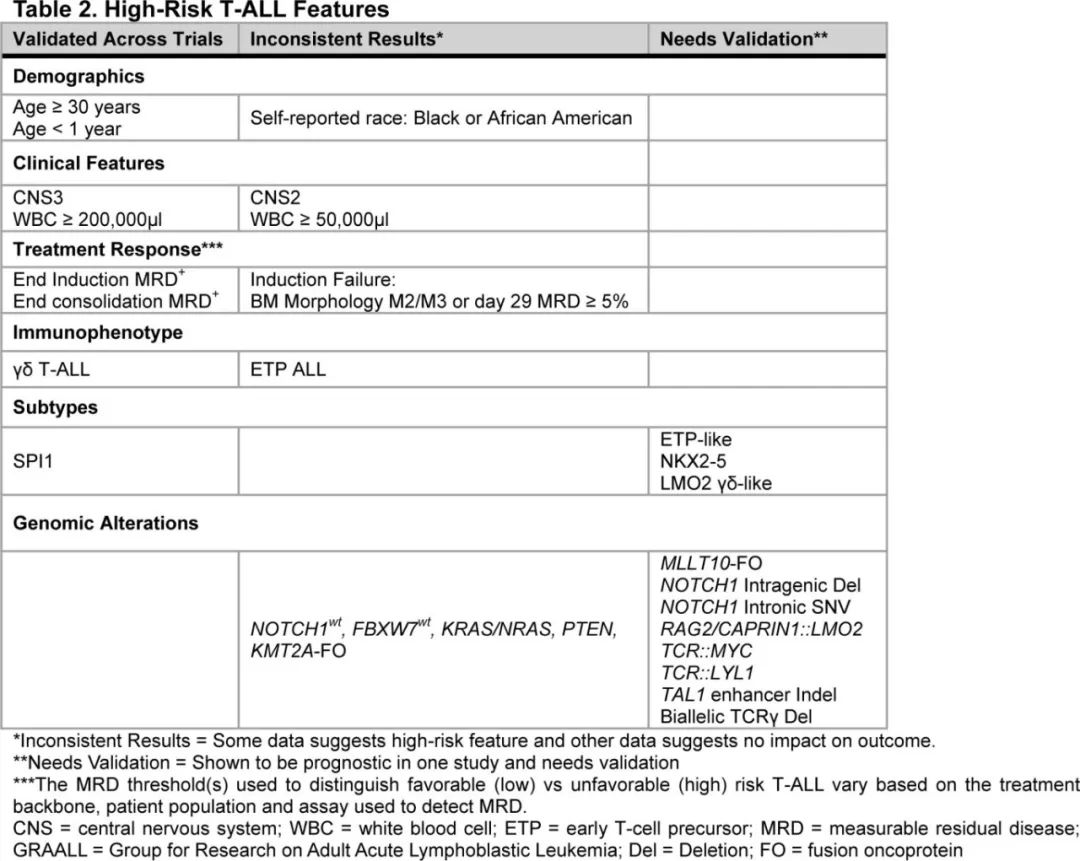
TAL1 亚型按分化分期可分为αβ样和 DP 样亚型,并进一步分为临床结局不同的遗传亚组。TAL1 DP样亚型具有CD4、CD8、RAG1和 RAG2 高表达,可分为四组,其特征为:(1)RPL10 突变(TAL1 DP样RPL10);(2)LEF1SV和缺失或 LYL1 改变(TAL1 DP样LEF1/LYL1);(3) 激活 Jak 信号(例如IL7R、STAT5B)的突变(TAL1 DP样Jak);(4) 其他异源性病变(TAL1 DP样其他)。与RPL10和JAK组相比,TAL1 DP样LEF1/LYL1和其他组的EFS和DFS较差。TAL1 αβ样亚型由TCRαβ重排和 TCR α恒定 (TCR) 基因的高表达所定义,可分为3组:(1)PTEN缺失、PI3K通路改变和 NOTCH1野生型(TAL1αβ样NOTCH wt);(2)6q缺失(TAL1βα样6q缺失);(3) 其他改变,包括无 6q 缺失的 NOTCH1 突变(TAL1αβ样其他)。与“NOTCH wt”和“6q缺失”组相比,TAL1αβ样“其他”组的预后较差。
同样,根据基因表达谱可将 TLX3 亚型分为‘TLX3未成熟’和‘DP样’亚型。TLX3未成熟基因的预后更差,并且与激酶信号失调的各种共病变有关。重要的是,Po lo nen等发现 SPI1 亚型常发生与树突状细胞来源的朗格汉斯细胞组织细胞增多症和髓样肉瘤相关的继发性肿瘤,且预后不佳。SPI1 融合在第二肿瘤中被保留,具有与 T-ALL 至组织细胞转化相关的克隆变化,如 BRAF 突变克隆扩增。总之,已确定的预后因素主要与受分化分期、癌基因激活机制和亚型特异性凝聚影响的亚型有关。
Kimura 等最近的一项研究检测了200例γδT-ALL患儿,发现了与该型白血病相关的高风险因素,特别是3岁以下儿童和 STAG2/LMO2 亚型患儿。此外,其他γδT-ALL病例富集高危亚型,如 ETP 样、MLLT10和中危 TLX3 未成熟,但在 TAL1 亚型中未发现。另一种高危亚型为LMO2 γδ样T-ALL,其中大多数病例携带BCL11B::LMO2重排、γδTCR重排,表现出与成熟正常γδ细胞相似的基因表达谱,通常对诱导治疗反应不佳(第29天MRD >5%)。这些结果强调了也根据 TCR 重排状态和基因组特征对 T-ALL 进行分类的重要性,因为其与 T 细胞发育中的替代分化通路相关。
DNA CpG 甲基化与 T-ALL 结局之间的相关性已有报道,但尚不清楚这些相关性是否独立于基因组亚型和驱动改变。CpG岛甲基化表型 (CpG Island Methylator Phenotype,CIMP) 与高甲基化肿瘤的良好预后相关,而低甲基化与较差的预后相关。有研究试图完善基于甲基化的亚组,并了解不同甲基化特征背后的机制,但已确定的遗传驱动改变的缺口对全面的基于 DNA 甲基化的分类提出挑战。DNA甲基转移酶(例如DNMT3A和DNMT3B)及去甲基化酶抑制剂(例如IDH1、IDH2)或甲基化抹除剂(例如TET1、TET2)的改变在成人 T-ALL 中很常见,但在儿童 T-ALL 中罕见,因此年龄是解释甲基化特征的重要因素。Roels等的研究表明异常的甲基化谱可反映 T-ALL 的表观遗传史,且在儿童患者中始于T-ALL之前的前白血病胸腺细胞。此外,确定异常甲基化背后的机制及其亚型相关性是未来研究的重要方向,因为可通过去甲基化药物治疗。
开发 T-ALL 预后模型
结合临床和基因组信息的预后模型可进行最佳的风险分层。在多个队列中应用的唯一分类器为5基因(NOTCH1、FBXW7、NRAS/KRAS和PTEN)风险分类器,其首先从两个成人队列(GRAALL-2003和GRAALL-2005)中识别,随后应用于两个欧洲儿童队列(FRALLE2000T,N=220)、UKALL2003,N=145)。然而,诊断时筛查 PTEN 或 RAS 异常并不能细化 UKALL2003 队列的风险分层。最近,Simonin等提出了一种新的基于 NGS 的 T-ALL 风险分层,可对成人和儿童 GRAALL2003/2005 和 FRALLE2000T 队列进行有效分层。该分层旨在通过纳入额外的编码改变和诊断性 WBC 计数及诱导结束时 MRD (基于聚合酶链反应)来改善4基因分类器。4个基因(NOTCH1/FBXW7、PHF6和EP300)与良好结局相关,而NRAS、KRAS、PI3K通路基因、TP53、DNMT3A、IDH1、IDH2、和 IKZF1 与较高的复发率相关。最后,Po lo nen等人开发了两种准确的风险分层框架:(i) penalized Cox regression (pCox) 模型,包括临床变量(连续MRD、CNS状态3、WBC≥200000/µl)、5个亚型和18个基因组改变,以数据驱动的方式从所有改变和亚型中选择;(ii) 生存树 (ST),根据亚型或遗传亚组将组分为4个风险组,MRD≤0.1% vs > 0.1%。两者可互补:pCox允许高度准确地分层为4个大小相等的组,而 ST 根据与疾病分类相关的类别提供分层。
未来展望
为了促进对 T-ALL 的理解,WGS和 WTS 数据的综合分析对确定基因组改变至关重要,从而可以定义疾病亚型、进一步对亚型进行分层并确定治疗反应。最近的数据有力地表明,通过基因组分析鉴定15种 T-ALL 亚型和鉴定驱动因子对于准确的 T-ALL 分类和预后至关重要,但需要在独立队列中验证这些结果。此外,评估 FLT3 内部串联重复 (ITD) 的等位基因分数对急性髓系白血病的预后分类很有价值,表明筛选 T-ALL 中的相似生物标志物可提供重要的预后见解。同时,胚系易感性和遗传血统对结局的影响也需要评估。还需要对不同 T-ALL 亚型和遗传亚组进行机制性研究,且评估不同亚型内精准治疗的靶向性至关重要。例如,Gocho等确定,基于 preTCR-LCK 激活,预测约40%的儿童 T-ALL 病例对达沙替尼治疗敏感,其在TAL1、TAL2或 LMO1/2 过表达的病例中高度富集。TAL1αβ 样亚型(对应于表达单阳性/成熟 T 细胞成熟阶段的TCRA)和 TAL1 DP 样亚型(对应于循环双阳性 T 细胞)具有特别高的 LCK 表达。作为另一个例子,高通量药物筛选确定 STAG2/LMO2 亚型中 STAG2 失活的 DNA 修复通路的潜在脆弱性,可通过聚(ADP-核糖)聚合酶 (PARP) 抑制剂进行靶向。因此,基因组分析可能有助于确定更可能从靶向治疗中获益的患者,也是未来研究的一个重要领域。此外,研究复发机制及其与特定亚型的关系非常重要,虽然目前的分析主要集中于复发的遗传学驱动因素上,但迫切需要探索复发和治疗耐药的非遗传机制。新出现的关于复发中非编码改变的研究提出了一个有希望的、以前探索不足的领域,例如鉴定出 TAL1 增强子插入缺失和劫持 RAG2 或 CAPRIN1 增强子(通过 LMO2 和 NOTCH1 基因内缺失)与较高的累积复发率相关。
总结
T-ALL 分类的最新进展和关键复发机制的发现,为 T-ALL 疾病生物学和进展的机制理解提供了路线图。下一个关键阶段为在独立队列中基准疾病分类和风险分层方法,并将基因组知识转化为改进的治疗策略,从而带来更高的缓解率、更低的复发率,并最终增加生存率。
参考文献
Pölönen P, et al.Classification and risk stratification in T-lineage acute lymphoblastic leukemia.Blood . 2024 Oct 2:blood.2023022920. doi: 10.1182/blood.2023022920.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#急性淋巴细胞白血病# #T-ALL#
0