STM:双抗靶向递送改善多柔比星脂质体治疗高危儿童白血病
2023-07-16 儿童肿瘤前沿 儿童肿瘤前沿
该研究证明了将有明确疗效的PEG脂质体多柔比星制剂与灵活的双抗靶向相结合的治疗效果。
急性淋巴细胞白血病(ALL)是最常见的儿童癌症,其生存率已超过90%。然而,B细胞ALL的儿童/婴儿治疗失败和复发风险很高,复发后只有不到40%的患儿存活。同时,患有混合谱系白血病基因重排(MLLr) 的急性髓性白血病(AML)患儿复发率大于50%,预后较差。因此,需要开发更安全、更有效的新方法改善这些患儿的临床结果。
脂质体给药系统优化了化疗药物的药代特征和治疗指标,有潜力改善血液系统恶性肿瘤的治疗。聚乙二醇修饰(PEG化)脂质体多柔比星(Caelyx)是美国FDA批准的第一个脂质体药物,在治疗多发性骨髓瘤、浆细胞白血病、B细胞ALL和淋巴瘤方面显示出显著的临床效果。但脂质体药物目前还不能特异性靶向癌细胞,大部分积聚在肝脏、脾脏、肾脏和其他健康器官,造成全身性损害,带来的副作用阻碍其儿科适应症获批。因此,优化脂质体药物对癌细胞的选择性是促进其治疗安全有效的关键。
近日,澳大利亚新南威尔士大学的 Maria Kavallaris 教授在 Science Translational Medicine 上发表题为 Delivery of PEGylated liposomal doxorubicin by bispecific antibodies improves treatment in models of high-risk childhood leukemia 的文章。该研究开发了一种双特异性抗体脂质体靶向平台, 双抗两端分别与白血病细胞受体(CD19、CD20、CD22或CD38)和Caelyx纳米颗粒表面的PEG结合,用于靶向递送PEG化脂质体药物Caelyx到白血病细胞。结果显示该靶向平台可增强脂质体药物Caelyx的治疗效果和安全性,从而改善高风险白血病的治疗。

本研究开发的双抗可结合白血病细胞并被有效内化
CD19、CD20、CD22和CD38细胞表面受体在B系ALL细胞中表达,CD38的表达还延伸到AML细胞和T系ALL。双抗的一端使用抗PEG单链可变片段(scFv),另一端分别使用抗cd19、抗cd20、抗cd22、抗cd38 scFv序列,均来自自商业化治疗性单克隆抗体(分别为blinatumomab、caratuzumab、moxetumumab pasudotox-tdfk和HB-7),由此生成四个双抗,分别称为αCD19、αCD20、αCD22和αCD38,用于PEG脂质体药物选择性靶向ALL、AML和T-ALL细胞。该研究检测了双抗对一组B-ALL和T-ALL 细胞系的细胞靶向能力。显示αCD19、αCD20和αCD22抗体选择性结合并内化进B-ALL细胞,而不是T-ALL细胞;而αCD38结合并内化到B-ALL和T-ALL细胞。在所有双抗中,αCD22的内化程度最高,并均匀分布在B-ALL细胞的细胞质中。这些双抗的细胞靶向和内化模式也与商业单克隆抗体相当,这表明将PEG结合臂整合到靶向白血病的scfv中不会损害其结合和内化白血病细胞的能力。
双抗通过双向靶向将PEG脂质体纳米颗粒重定向到白血病细胞
该研究证实靶向双抗可以介导PEG化脂质体纳米颗粒以PEG选择性方式靶向白血病细胞,并确定靶向双抗的PEG化脂质体是以受体特异性方式与白血病细胞结合。因此双抗对PEG和白血病细胞表面受体的双重靶向介导了PEG脂质体纳米颗粒与白血病细胞的特异性结合。
该研究通过优化了双抗分子在Caelyx上的密度,最大限度提高细胞靶向性,并防止添加双抗对Caelyx大小和稳定性的负面影响。研究结果表明,构建的双抗有效地提高了Caelyx与白血病细胞的特异性结合,同时不会对其稳定性和结构产生不利影响(图1)。
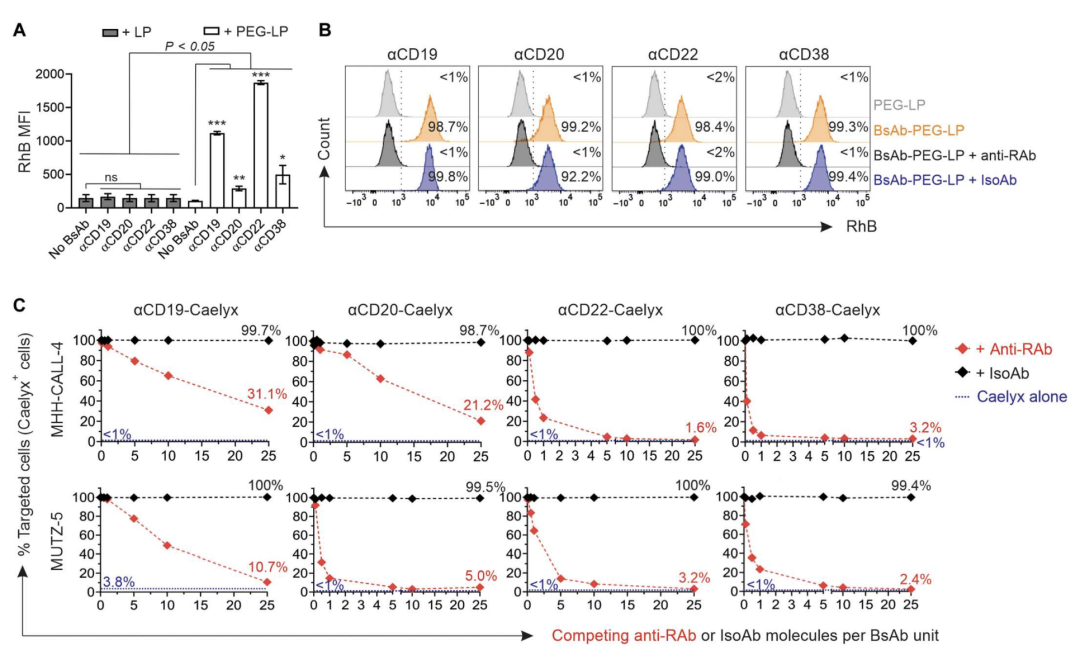
图1.双抗与PEG和CD19、CD20、CD22或CD38的双重结合介导了PEG化脂质体纳米颗粒对白血病细胞的选择性靶向
双抗介导Caelyx对高危儿童白血病亚型的体外靶向递送
测试了13个分子特征的细胞系和3个患者来源的细胞样本,这些样本代表了与持续复发和低生存率相关的疾病亚型。将白血病细胞与双抗-Caelyx复合物(αCD19-Caelyx、αCD20-Caelyx、αCD22- Caelyx、αCD38-Caelyx)或单独Caelyx孵育,然后分别通过活细胞共聚焦显微镜和流式细胞术分析测定其细胞摄取和靶细胞百分比(图2)。结果表明,αCD19、αCD22、αCD38以及αCD20(在较小程度上)通过选择性结合疾病特异性细胞表面受体,成功增强了Caelyx对多种高危儿童白血病亚型的靶向和递送,并进一步确定了这种策略在治疗免疫表型多样化的高危儿童白血病亚型中的多功能性。
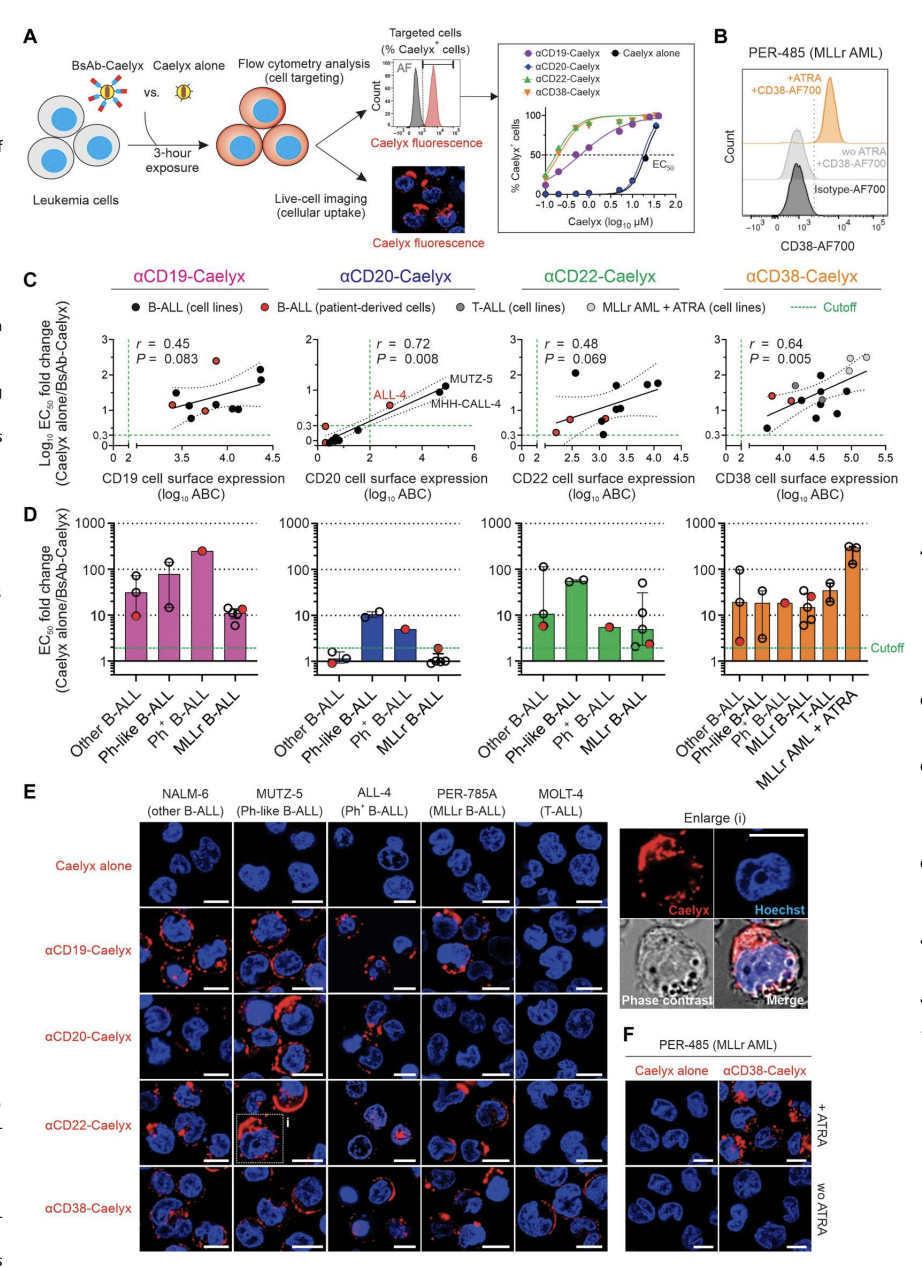
图2.双抗-Caelyx复合物在体外对异质高危白血病细胞的结合和内化增强
双抗增强了Caelyx对高危儿童白血病细胞的细胞毒性
测试Caelyx与双抗的络合是否能提高其对高危白血病细胞系和患者来源细胞样本的细胞毒活性。结果显示(图3),所有B-ALL细胞系和患者来源的细胞对至少一种双抗-Caelyx复合物有反应,所有B-ALL细胞,以及五种MLLr B-ALL群体中的三种,都能有效地用两种或更多不同的复合物治疗。此外,αCD38-Caelyx的抗白血病作用进一步扩展到所有T-ALL和MLLr AML细胞系,与单独Caelyx相比,其IC50值分别小2.6倍和23.4倍。更重要的是,与αCD19、αCD20、αCD22或αCD38 bsab络合后,Caelyx对HMEC-1内皮细胞的细胞毒性没有改变。
双抗诱导的Caelyx细胞毒性作用的改善是否与细胞靶向性和白血病细胞受体表达的增强相关?结果发现,细胞毒性的提高原因有:双抗与CD19或CD38的相互作用,这些受体的高密度,和更多的Caelyx摄取。共聚焦显微镜显示,B-ALL细胞系和患者来源的细胞更有效地内化αCD22-Caelyx,对其治疗作用更敏感。内化活性最高的细胞(ALL-2、ALL-4、PER-785A、MLL-14和REH)尽管靶向效率更低或CD22细胞表面表达更低,但仍显示出相关的治疗反应。总之,双抗-Caelyx复合物对高危儿童白血病具有出色的细胞毒性活性,而对缺乏受体表达的细胞没有作用(图3)。
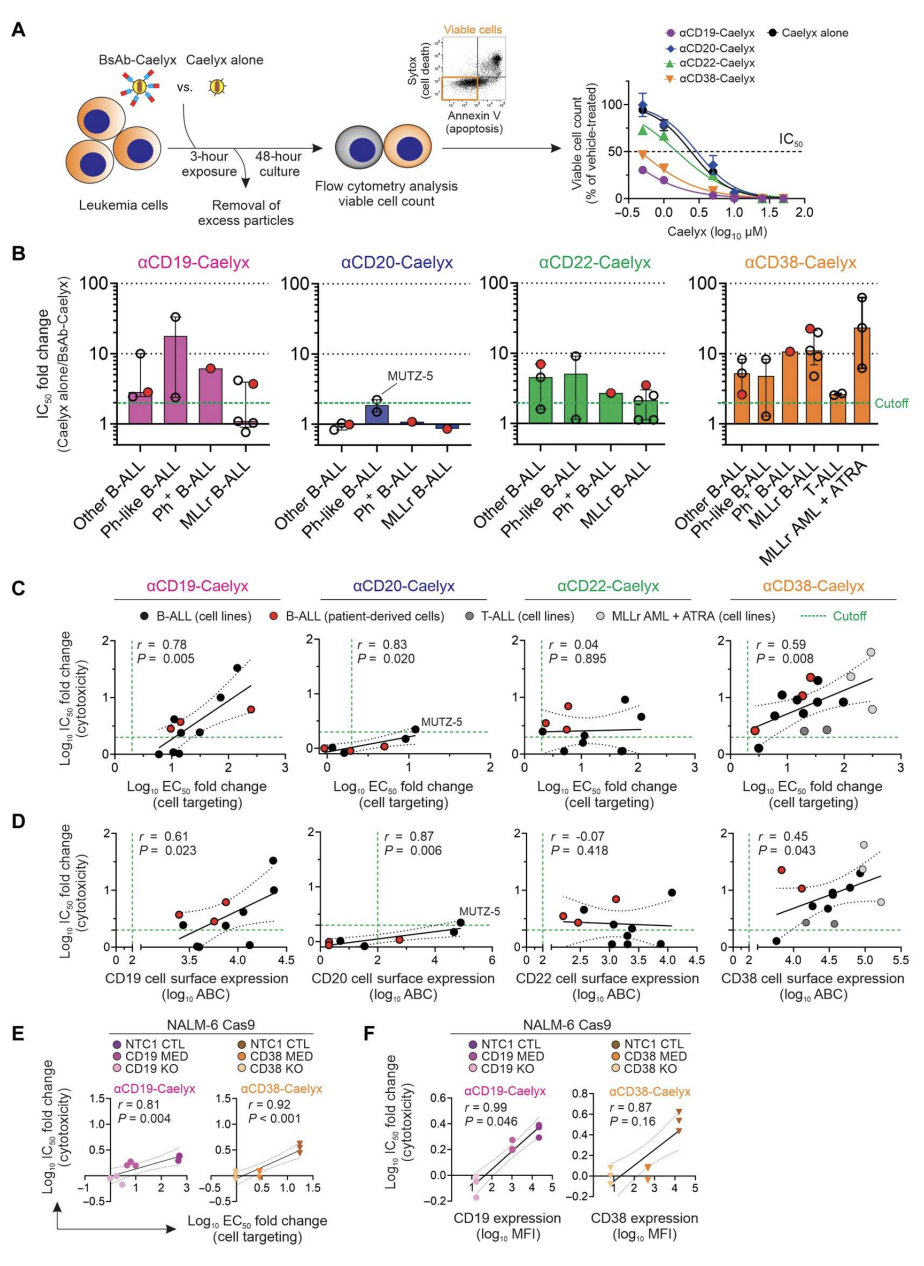
图3.双抗-Caelyx复合物在体外对异质性高危白血病细胞的治疗效果有所改善
双抗-Caelyx复合物对健康血液单核细胞安全
CD19、CD20、CD22和CD38在正常B细胞发育的大多数阶段表达,CD38在T细胞、单核细胞和造血祖细胞(HPC)上表达。因此,研究确定了双抗-Caelyx复合物是否可以结合并导致这些正常细胞的活力降低,HPC暴露于这些复合物是否会损害它们分化成多谱系的能力。结果表明,Caelyx与αCD19、αCD20、αCD22或αCD38 双抗联合使用可显著增强其对白血病细胞的靶向性和选择性细胞毒活性,对PBMC和HPCs的作用有限(图4)。
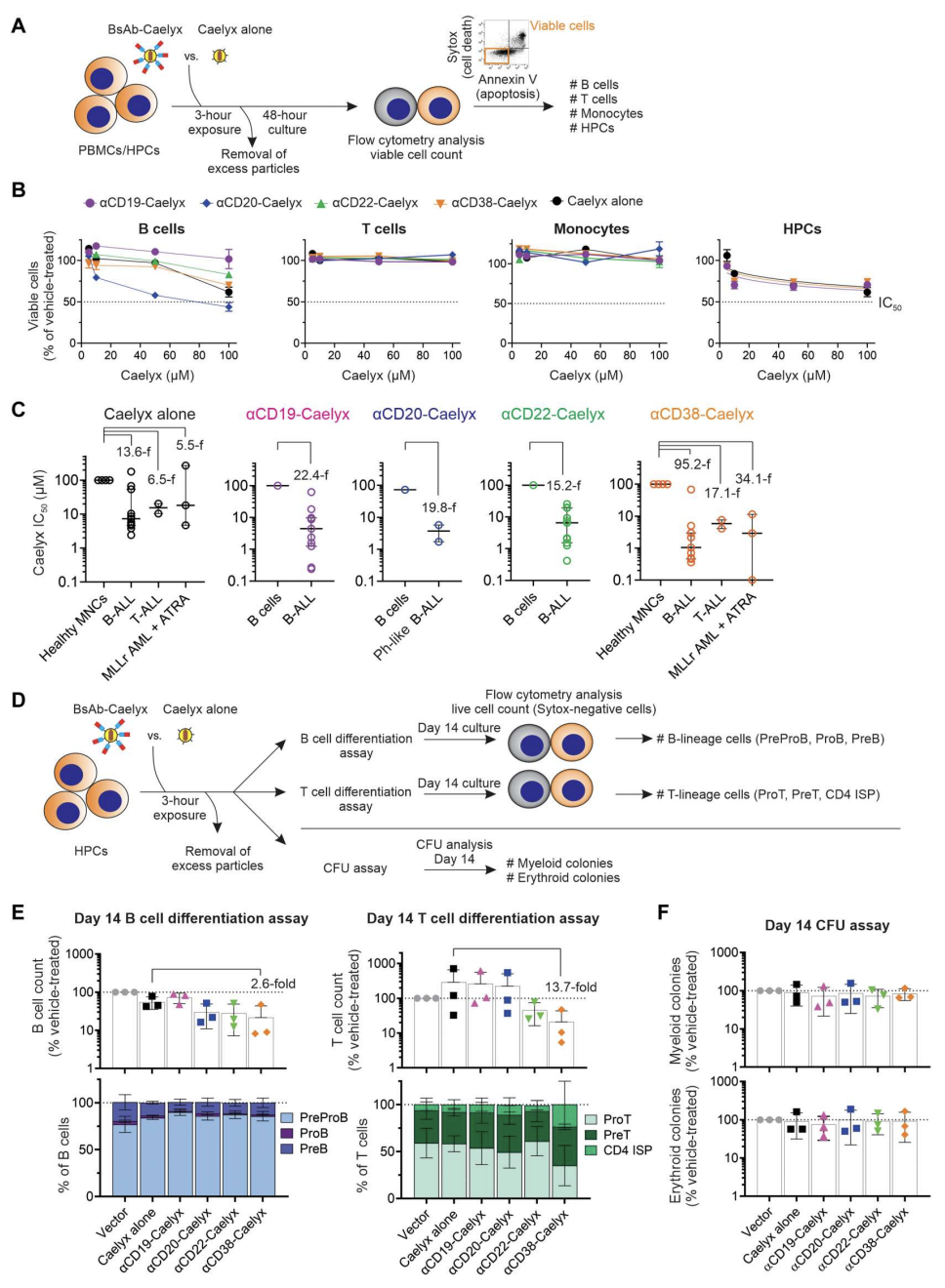
图4.双抗-Caelyx复合物对体外正常PBMC和HPCs的毒性和免疫抑制很小
多路双抗能克服免疫逃逸,最大化Caelyx抗白血病活性
该研究开发的双抗组合方法还有一个关键优势是多路复用能力。研究发现,Caelyx通过多个双抗的复合物靶向白血病细胞,可获得更大的药物递送和细胞毒性,同时克服了缺乏某单一受体表达细胞的免疫逃逸。多重双抗-Caelyx对患者源性细胞的靶向效率和细胞毒性明显优于单个双抗Caelyx复合物。(图5)
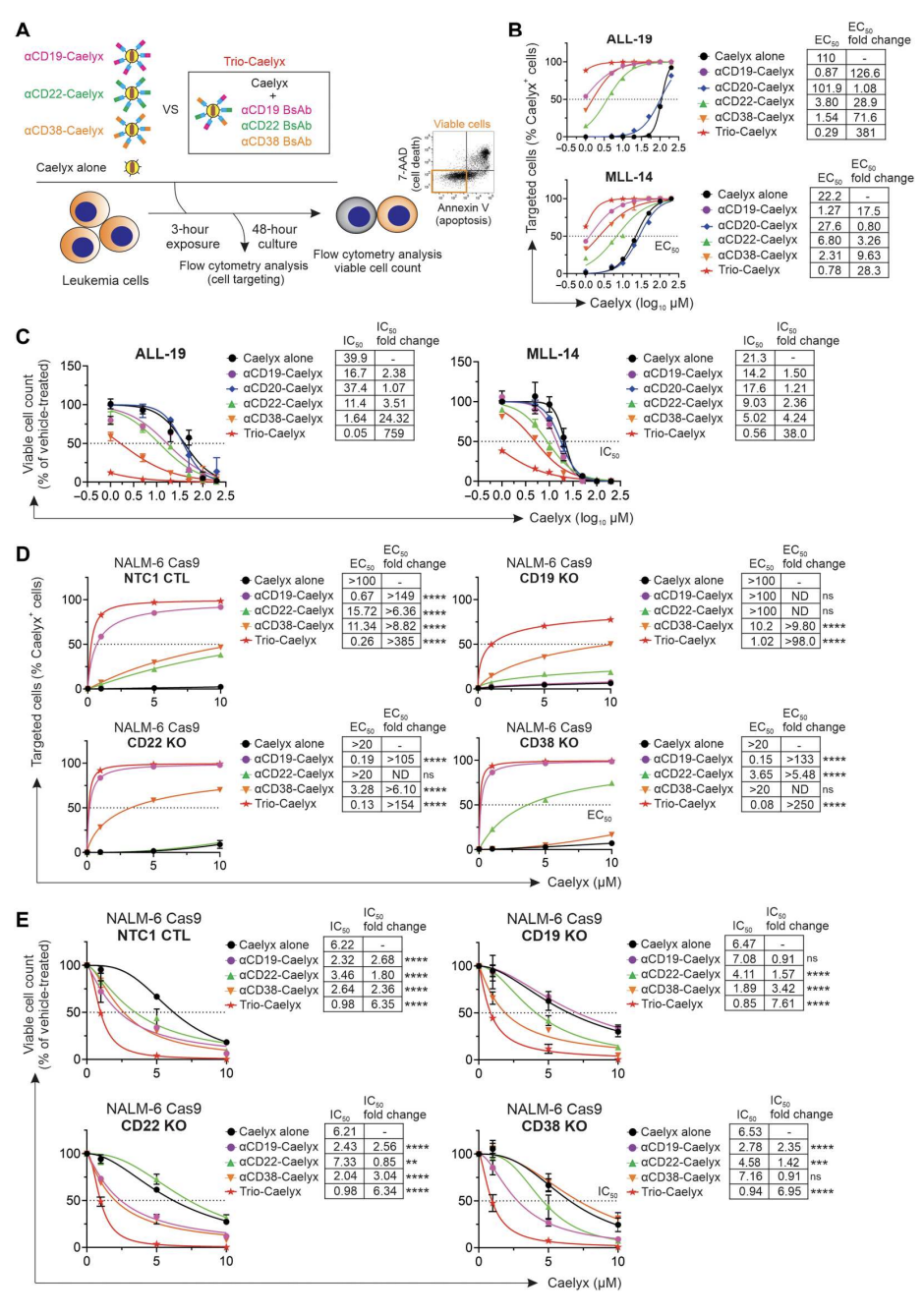
图5.在高风险白血病细胞和抗原敲除工程细胞系中,Trio 双抗-multiplexed Caelyx (Trio-Caelyx)在体外优于单一双抗靶向复合物的细胞靶向性和细胞毒性
双抗-Caelyx复合物延长了高风险白血病PDX模型的生存期,并在CD34+ HPC移植小鼠中诱导最小的免疫抑制
用移植ALL-19或MLL-14细胞的高风险儿童白血病PDX小鼠模型研究双抗-Caelyx复合物在体内的治疗效果。与单独接受Caelyx的小鼠相比,αCD22-Caelyx、αCD38-Caelyx和αCD19- Caelyx处理的小鼠的中位无事件生存期(EFS)分别增加了约3倍、2.3倍和2.1倍,有效抑制了MLL-14的进展。靶向MLL-14细胞中不存在的CD20,对Caelyx的生物分布或EFS没有影响。trio -Caelyx处理的小鼠的中位EFS与αCD22- Caelyx处理的小鼠一样高。
在ALL -19移植小鼠中观察到类似的治疗效果,αCD22-Caelyx、αCD38-Caelyx、Trio-Caelyx和αCD19-Caelyx,而不是αCD20- Caelyx或单独Caelyx,均能减轻白血病扩展并显著延长生存期, EFS分别比载体处理小鼠高3至4.2倍,3倍,3.3倍和1.8倍。与其他复合物相比,αCD19-Caelyx在体内的效力较差,可能由于白血病细胞中CD19的丰度较低或有限的内化。(图6)
最后,在CD34+ HPC移植的小鼠中研究了抑制白血病进展的复合物和剂量是否会损害正常的人类造血功能。αCD20-Caelyx和αCD38-Caelyx诱导了B细胞发育的短暂抑制,在治疗完成后不久血液中的B细胞数量恢复。αCD38-Caelyx也被发现在第14天引起单核细胞增殖的短暂减少,此后计数恢复。所有复合物都有良好的耐受性,且在长期给药中不会改变骨髓或脾脏中早期B细胞、T细胞、单核细胞或造血干细胞祖细胞的数量。
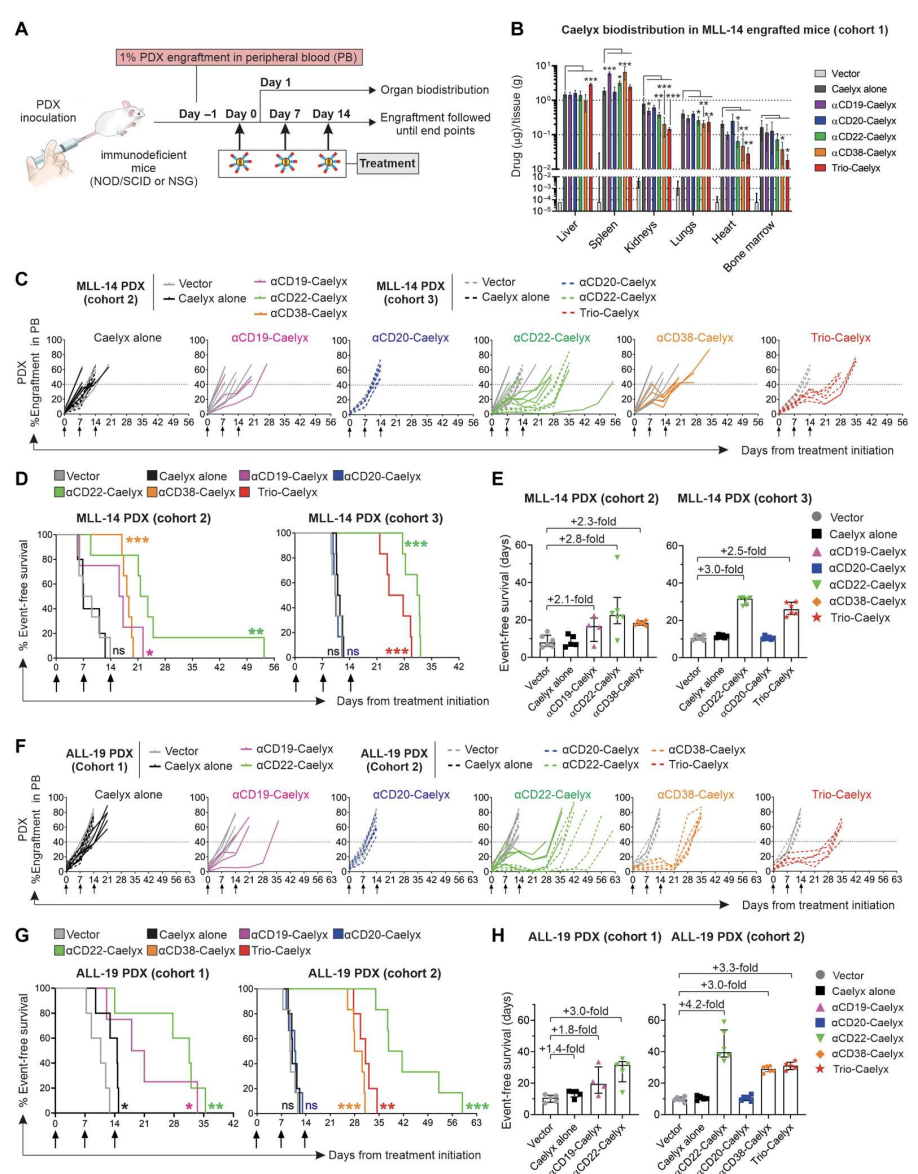
图6. 双抗-Caelyx复合物在PDX疾病模型中改善了高危白血病的生物分布并抑制了其增殖
将该研究开发的双抗-Caelyx疗法引入临床仍然存在一些障碍,比如免疫原性。靶向白血病的双抗scFvs来源于小鼠单克隆抗体,可能引发不必要的免疫原性反应。Trio-Caelyx复合物在肝脏中有积累,而单一的双抗-Caelyx复合物则不会,表明多种不同的双抗复合物可能增强免疫原性并触发单核吞噬细胞系统识别。
本研究存在局限包括:
一、双抗-Caelyx复合物在体内的治疗效果仅通过两种B-ALL PDX模型进行测试,这些模型不能代表高风险儿童白血病的全部遗传和表型多样性。未来的疗效研究需要更多PDX模型,包括T-ALL和AML分离株,来证明该治疗方法的普遍性和临床可转化性。二、该研究使用免疫功能低下的小鼠,这阻碍了对免疫反应的评估,可能会增强或阻碍复合物的功效。三、尽管已经确定了Caelyx在成人中的安全剂量,但缺乏对儿童和婴儿的研究,在启动双抗-Caelyx复合物的临床试验之前,需要对儿童和婴儿进行准确的毒性分析。
总之,该研究证明了将有明确疗效的PEG脂质体多柔比星制剂与灵活的双抗靶向相结合的治疗效果。这种治疗方法可能成为高风险白血病儿童的另一种治疗选择,它适用于疾病的多种形式,还具有低毒性。该研究的双抗靶向技术还可扩展到治疗其他CD19、CD20、CD22或CD38阳性的血癌,如浆细胞肿瘤或淋巴瘤。总之,利用双抗靶向纳米治疗代表了血液癌症精准医学进步的一个里程碑。
DOI: 10.1126/scitranslmed.abm1262
作者:儿童肿瘤前沿
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言