只有高质量的研究设计才是研发抗癌新药造福于全球癌症患者的基石
2018-06-17 慧语 贾老师 肿瘤资讯 良医汇
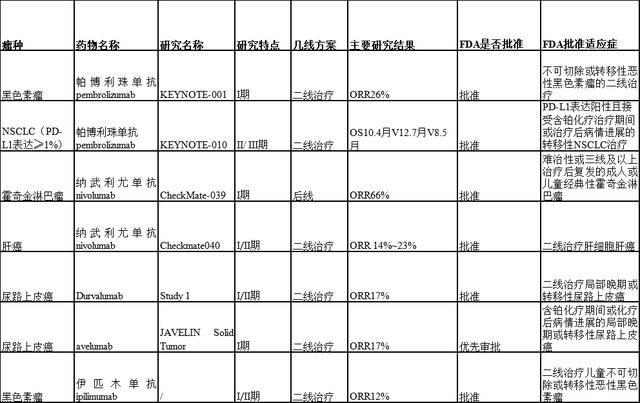
肿瘤药物研发日趋成熟,无论是制药行业还是政府监管部门亦或是其它学术组织,都迫切希望在评价抗癌新药、尤其是“变革性”创新药疗效时能尽可能地提高效率、降低成本,加速满足癌症患者的迫切需求。但提速的同时兼顾时效性和伦理学问题仍不容忽视。在时代的机遇和使命面前,无缝(Seamless)设计作为一种创新性的临床试验理念能否担此重任,脱颖而出呢?--请看新英格兰杂志如何评价。

作者:慧语 贾老师
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#抗癌新药#
51
学习了.长知识
81
#癌症患者#
32
#研发#
42
学习了受益匪浅
85