Nat Commun:肠道细菌如何影响帕金森病的治疗
2019-01-30 佚名 生物通
发表在Nature Communications杂志上的研究,格罗宁根大学的科学家发现肠道细菌能将左旋多巴代谢成多巴胺。由于多巴胺不能穿过血脑屏障,这使得药物的疗效降低,即使存在会阻止左旋多巴转化为多巴胺的抑制剂。
发表在Nature Communications杂志上的研究,格罗宁根大学的科学家发现肠道细菌能将左旋多巴代谢成多巴胺。由于多巴胺不能穿过血脑屏障,这使得药物的疗效降低,即使存在会阻止左旋多巴转化为多巴胺的抑制剂。
帕金森病患者用左旋多巴治疗,左旋多巴可以转化为多巴胺,一种大脑中的神经递质。发表在Nature Communications杂志上的研究,格罗宁根大学的科学家发现肠道细菌能将左旋多巴代谢成多巴胺。由于多巴胺不能穿过血脑屏障,这使得药物的疗效降低,即使存在会阻止左旋多巴转化为多巴胺的抑制剂。
“肠道细菌可以影响大脑,这是公认的。”该文章的通讯作者、微生物学助理教授Sahar El Aidy解释说,“肠道细菌和大脑之间有一个连续的化学对话,也就是所谓的肠道-大脑轴。”El Aidy和她的团队研究了肠道微生物群对左旋多巴(一种治疗帕金森病的药物)生物效用的影响。
血脑屏障
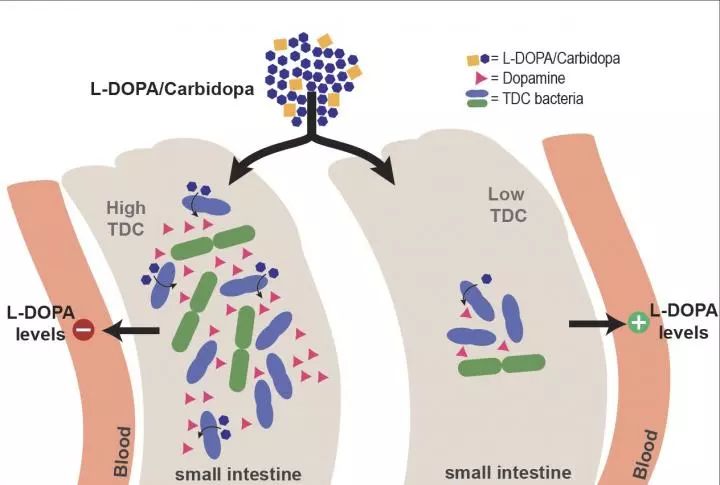
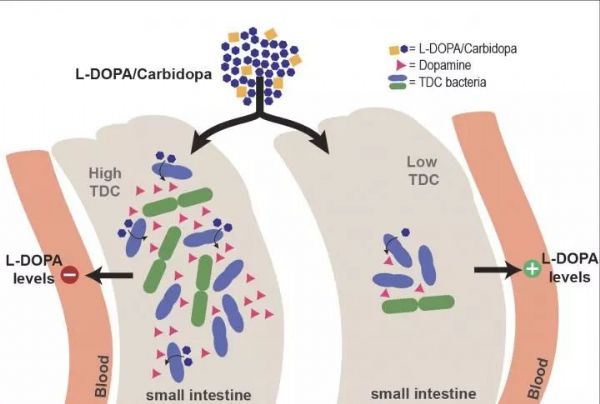
左旋多巴药物通常是口服的,左旋多巴被小肠吸收,然后通过血流输送到大脑。然而,脱羧酶能将左旋多巴转化为多巴胺。与左旋多巴相比,多巴胺不能通过血脑屏障,因此患者也被给予脱羧酶抑制剂。“但是,在帕金森病患者中,到达大脑的左旋多巴的水平差异很大,我们质疑肠道微生物群是否在这种差异中起作用,”El Aidy说。
在大鼠小肠的细菌样本中,Aidy的博士生Sebastiaan van Kessel发现了细菌酪氨酸脱羧酶的活性,这种酶通常将酪氨酸转化为酪胺,但同时也发现该酶能将左旋多巴转化为多巴胺。“然后我们确定脱羧酶的来源是肠球菌。” 研究人员还发现,高浓度的酪氨酸(细菌酪氨酸脱羧酶的主要底物)不会抑制左旋多巴的转化。
生物利用率
帕金森病患者同时也会服用脱羧酶抑制剂,所以他们下一步是测试几种人体脱羧酶抑制剂对细菌脱羧酶的影响。“测试的结果是,比如,抑制剂Carbidopa对人体脱羧酶的抑制作用是细菌脱羧酶的10000倍以上。”El Aidy说。
这些发现使研究小组得出这样的假设:细菌性酪氨酸脱羧酶的存在会降低帕金森病患者左旋多巴的生物利用效率。为了证实这一点,他们测试了正常和高剂量左旋多巴患者的粪便样本。编码酪氨酸脱羧酶的细菌基因的丰度越高的患者则需要越高剂量的药物。“因为这些都是粪便样本,左旋多巴会被小肠吸收,存在吸收能力的差异,所以这还不是确凿的证据。然而,我们证实了我们的观察结果:大鼠小肠中细菌脱羧酶的含量越高,血液中左旋多巴的含量就越低。”El Aidy说。
恶性循环
研究中的另一个重要发现是疾病持续时间与细菌酪氨酸脱羧酶水平呈正相关。一些帕金森氏病患者由于频繁摄入质子泵抑制剂而导致包括肠球菌在内的小肠细菌过度生长,他们使用质子泵抑制剂治疗与该病相关的胃肠道症状。总之,这些因素导致恶性循环,导致部分患者对左旋多巴/脱羧酶抑制剂的剂量需求增加。
El Aidy总结说,细菌性酪氨酸脱羧酶的存在可以解释为什么一些患者需要更频繁摄入左旋多巴来治疗他们的运动波动。“这被认为是帕金森病患者的一个问题,因为高剂量会导致运动障碍,这是左旋多巴治疗的主要副作用之一。”
原始出处:van Kessel SP, Frye AK, El-Gendy AO, et al. Gut bacterial tyrosine decarboxylases restrict levels of levodopa in the treatment of Parkinson's disease. Nat Commun. 2019 Jan 18;10(1):310.
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#COMMUN#
41
#Nat#
43
#肠道细菌#
38