复旦大学舒易来团队,最新Nature NBE:破解遗传耳聋密码,恢复听力!
2024-08-16 BioMed科技 BioMed科技
复旦大学团队用碱基编辑技术纠正小鼠致病突变,使听力长期稳定恢复,还在人源化小鼠中验证,为遗传性耳聋治疗提供新策略。
基因编辑“魔术师”让小鼠听力重生,持续超1.5年!
OTOF基因位于人类第8号染色体上,编码一种名为otoferlin的蛋白。Otoferlin是一种膜结合钙离子结合蛋白,主要在内耳的内毛细胞(IHCs)的突触小体中发挥作用,负责调节突触囊泡的钙依赖性释放,从而在听觉信号的传递中起到关键作用。在正常听觉过程中,声音信号通过耳蜗中的内毛细胞转化为神经信号,这些信号通过听神经传递到大脑。然而,当OTOferlin功能受损时,这一过程会受到显著影响。c.2485C>T,p.Q829X突变是一种常见的隐性突变,导致该基因编码的otoferlin蛋白产生提前终止的截短蛋白,丧失了其正常功能。这种突变的存在阻止了突触小体中囊泡的正常释放,最终导致神经信号的传递障碍,从而引发先天性重度听力损失。
在这项研究中,复旦大学舒易来研究团队展示了在携带与人类OTOF基因相同的突变(c.2482C>T,p.Q828X)的Otof小鼠模型中,使用由去氨酶 ABE7.10max 和 Cas9 变体 SpCas9-NG 组成的碱基编辑器(ABE),通过腺相关病毒包装并注射到小鼠内耳的圆窗膜中,成功纠正了致病突变,并未发现明显的脱靶效应。该治疗将88%的内毛细胞中的otoferlin蛋白水平恢复至接近正常,并将小鼠的听觉功能稳定恢复至接近野生型水平,持续超过1.5年,同时改善了内毛细胞的突触外排功能。作者还展示了一种针对流行的人类OTOF突变的腺嘌呤碱基编辑器在人源化小鼠中恢复了听力,达到与正常对照小鼠相当的水平。这表明,碱基编辑技术可能有效用于治疗遗传性耳聋。该研究以题为“A base editor for the long-term restoration of auditory function in mice with recessive profound deafness”的论文发表在最新一期《Nature biomedical engineering》。

遗传性耳聋是一种常见的感觉性障碍,主要由遗传因素引起。全球约有2600万人受先天性耳聋影响,其中约60%由遗传因素导致。听神经病谱系障碍(ANSD)是一种常染色体非综合征性听力损失,其特点是听觉信号传递出现问题,可能由于内毛细胞、突触、螺旋神经节神经元缺陷或听神经的脱髓鞘等引起。OTO基因是首个与ANSD相关的基因,负责41%至91%的ANSD病例,OTOF突变也导致2%至8%的先天性遗传性耳聋。c.2485C>T,p.Q829X是最常见的致病突变,导致严重的感音神经性听力损失。当前临床无有效药物治疗,尽管早期试验显示一定效果,但长期效果和安全性仍需验证。
为了研究OTOF p.Q829X突变在听力损失中的作用并探索治疗方法,作者利用CRISPR/Cas9技术构建了一个含有相同突变(Otof: c.2482C>T, p.Q828X)的鼠模型。免疫组化结果显示,正常小鼠的耳蜗内毛细胞中otoferlin蛋白正常表达,而OtofQ828X/Q828X纯合小鼠则未见otoferlin表达。听觉测试表明,Otof+/Q828X杂合小鼠的听力与野生型小鼠相当,而OtofQ828X/Q828X小鼠则出现了完全的听力丧失,与患者的听力丧失表型一致。
在ABE治疗研究中,传统上使用融合WT SpCas9的腺嘌呤脱氨酶。然而,OtofQ828X小鼠模型中的致病突变位于ABE的活性窗口内,但经典NGG PAM序列未找到。为解决此问题,作者选择了三种非经典PAM序列的SpCas9变体(SpCas9-NG、SpG和SpRY),并与TadA-8e脱氨酶结合,生成了NG-ABE8e、SpG-ABE8e和SpRY-ABE8e。使用这些ABE系统在Neuro2a(N2a)-OtofQ828X细胞中进行编辑,结果显示纠正率分别为53.7%、48.8%和62.6%,但也观察到旁观者编辑现象。插入/缺失频率较低。由于ABE7.10max的活性窗口较窄,作者评估了其纠正效率,发现与ABE8e相似,但旁观者编辑显著减少。NG-ABE7.10max被选为后续实验的编辑器。因其大小超出AAV载体的包装容量,作者将其分为两部分并重新组装。分裂的NG-ABE7.10max在N2a-OtofQ828X细胞中的纠正效率为30.1%,稍低于完整版本。最终,分裂的NG-ABE7.10max用于后续体内研究。
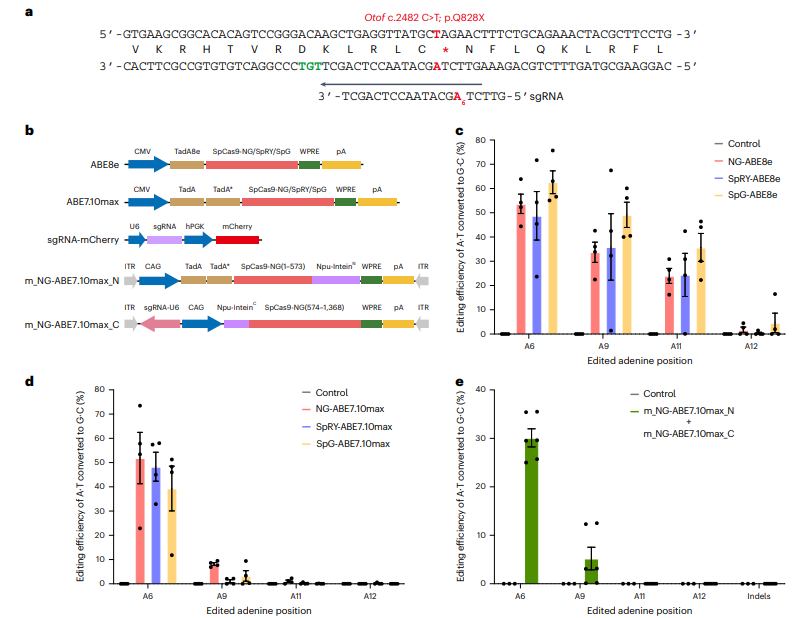
图1. 体外筛选OtofQ828X碱基编辑的最佳ABE
NG-ABE7.10max的N端和C端分别包装到AAV-PHP.eB载体中,用于转导毛细胞。作者将这两种AAV(各1.5 × 10^10 vg)混合注射到P1–3阶段的OtofQ828X/Q828X小鼠内耳,通过圆窗膜进行注射。四周后,通过高通量测序(HTS)检测到的平均纠正效率为2.1%,与先前研究一致。为了更准确评估编辑效率,作者在注射后6个月收集耳蜗进行全片观察,并对毛细胞以外的组织进行精细解剖。提取基因组DNA后,测得编辑效率为13.8%,比新鲜耳蜗软组织中的2.1%高6.6倍。这表明,NG-ABE7.10max能够在体内非分裂细胞中实现高效、精确的编辑。
为评估NG-ABE7.10max的脱靶效应,作者使用GUIDE-seq技术对N2a-OtofQ828X细胞的基因组进行分析,发现12个潜在脱靶位点。通过Cas-OFFinder预测的18个潜在脱靶位点中,无显著A到G编辑现象。RNA脱靶分析显示,NG-ABE7.10max在转染后48小时观察到A到I编辑,但96小时后编辑水平降至背景水平,主要发生在UA基序。体内研究中,AAV_NG-ABE_m-sg治疗组与对照组相比,A到I转换位点未显著增加。这表明NG-ABE7.10max在体内具有较低的脱靶效应。
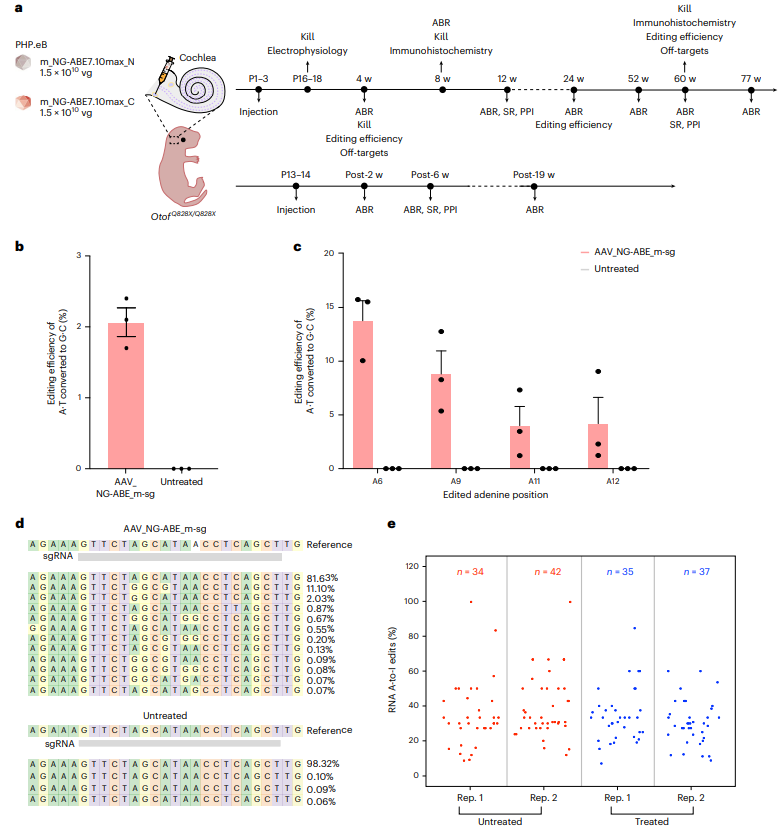
图2. NG-ABE对OtofQ828X/Q828X小鼠致病性突变的修正
在8周龄OtofQ828X/Q828X小鼠中,使用N端和C端otoferlin抗体评估了otoferlin表达,发现未有表达。将AAV_NG-ABE_m-sg注射到P1–3阶段的小鼠内耳后,约88.0±4.4%的IHCs中恢复了otoferlin表达。在耳蜗的基部、中部和顶端,otoferlin转导率分别为76.6±9.5%、88.6±3.8%和97.8±1.5%。还观察到对侧耳中也有otoferlin表达,可能因AAV进入脑脊液后转移到对侧耳。这表明AAV_NG-ABE_m-sg系统能有效恢复IHCs中的otoferlin表达。
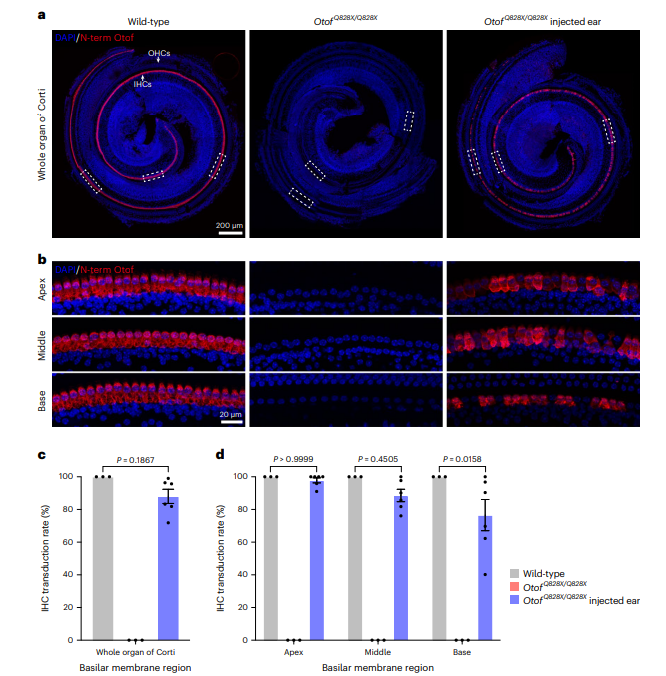
图3. 双AAV碱基编辑器处理恢复了otoferlin在耳聋小鼠OtofQ828X/Q828X中的表达
为了评估AAV_NG-ABE_m-sg系统的耳毒性,在OtofQ828X/Q828X小鼠中注射AAV_NG-ABE_m-sg后,4周内听力显著恢复,ABR阈值提高约30–47 dB SPL,接近正常小鼠水平。注射后8周和12周,听力改善持续。行为评估显示,治疗组小鼠的声启动反应(ASR)和预刺激抑制(PPI)显著增强,听觉感知和声音处理能力提升。即使在听觉发育后注射,听力仍能显著恢复,ABR阈值降低约29–44 dB,显示该系统在OtofQ828X/Q828X小鼠中有效恢复听力功能。
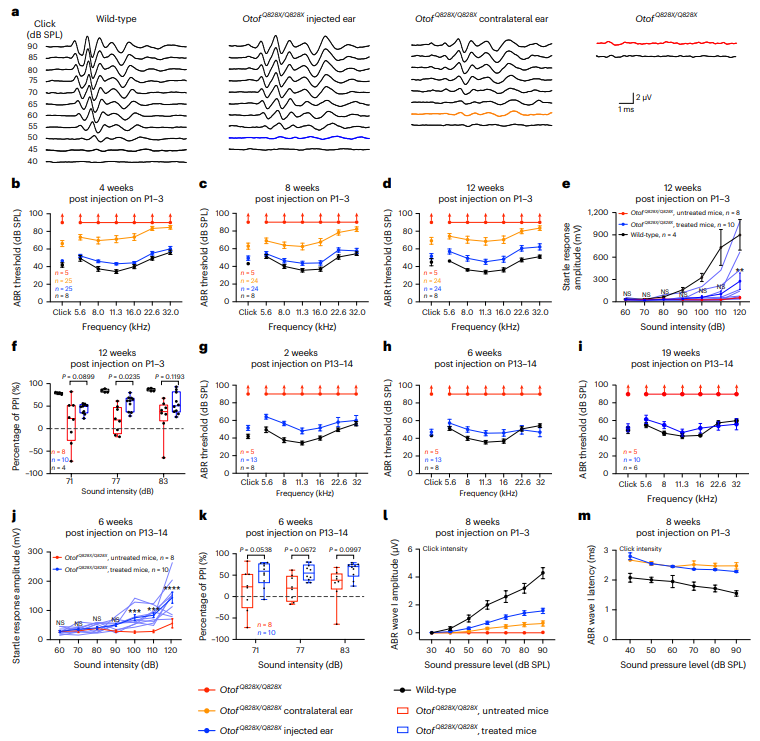
图4. 双AAV碱基编辑器治疗可恢复耳聋OtofQ828X/Q828X小鼠的听觉和行为功能
在P1–3注射AAV_NG-ABE_m-sg的OtofQ828X/Q828X小鼠中,听力在24周后与WT小鼠无显著差异,未治疗组则持续重度耳聋。治疗组在52周和60周后听力仍保持良好,60周后听力恢复到接近WT水平(约56–71 dB SPL),且这种效果持续超过一年。同样,治疗组对侧耳的听力也有所改善,尽管不及注射耳。ASR和PPI测试显示,治疗后60周小鼠的听觉反应和抑制能力明显优于未治疗组。耳蜗中otoferlin的表达在IHCs中良好维持,AAV_NG-ABE_m-sg系统的长期安全性良好,RNA和基因组DNA的脱靶效应未见显著增加。
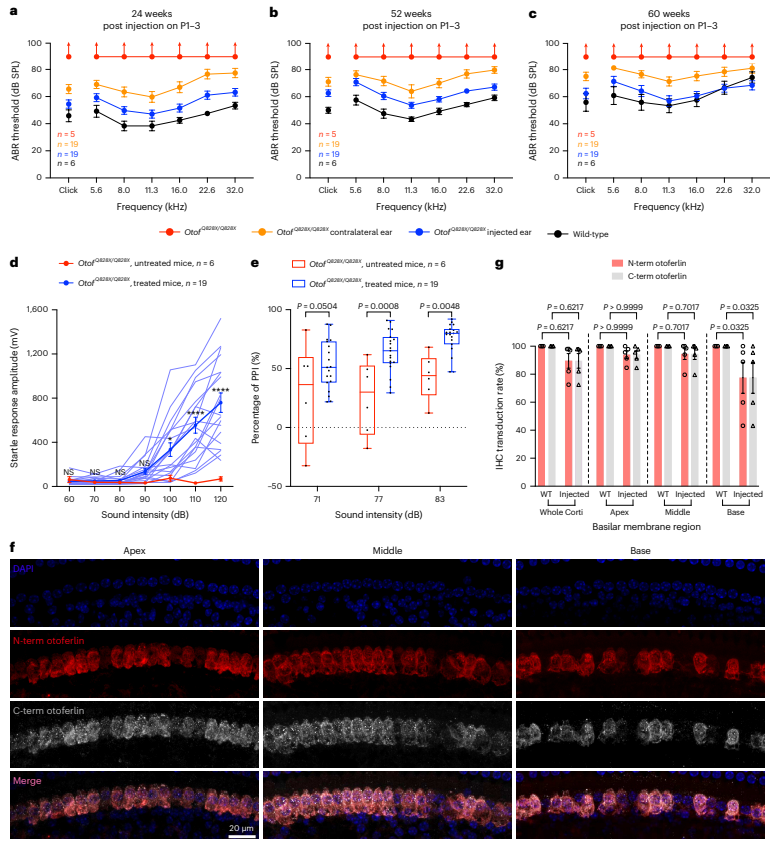
图5. AAV_NG-ABE_m-sg治疗可恢复耳聋OtofQ828X/Q828X小鼠的长期听觉功能
在P15的OtofQ828X/Q828X小鼠中,IHC的带状突触数量显著减少,突触聚集在IHC内侧。注射AAV_NG-ABE_m-sg系统后,受救IHC的突触数量明显增加(基底部: 8.8 ± 0.2,顶端: 9.6 ± 0.2,n=105 IHCs),且突触聚集现象得到缓解。为了评估OtofQ828X/Q828X小鼠IHC中Ca2+触发的突触囊泡胞吐作用是否恢复,研究在P16–18进行了全细胞膜片钳记录。结果显示,治疗组小鼠IHC的去极化诱导胞吐几乎恢复到WT水平(治疗组: 9.2 ± 1.4 fF,WT: 9.8 ± 1.6 fF),RRP(易释放池)和SRR(持续释放速率)也显著改善,分别达到WT水平。这些结果表明,体内碱基编辑能有效恢复OtofQ828X/Q828X小鼠的突触胞吐功能。
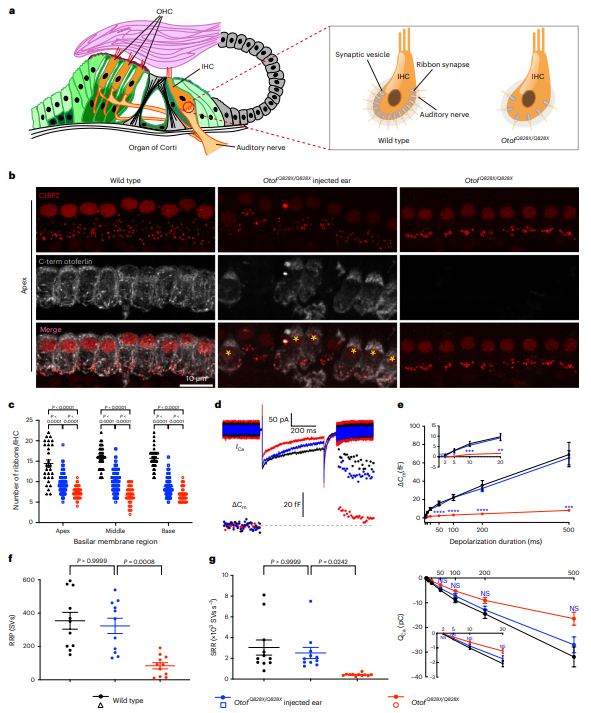
图6. AAV_NG-ABE_m-sg治疗可挽救耳聋OtofQ828X/Q828X小鼠Ca2+触发的突触胞吐
同时研究筛选了针对人类OTOF p.Q829X位点的ABE治疗系统。使用NG-ABE7.10max,修复率达71.6%,非目标编辑较少。将该系统注射至人源化OtofQ829X/Q829X小鼠内耳,4周后听力显著恢复,ABR阈值从>90 dB降至33.9 dB,接近WT小鼠水平。尽管检测到轻微的离靶效应,但安全性需在临床前进一步评估。
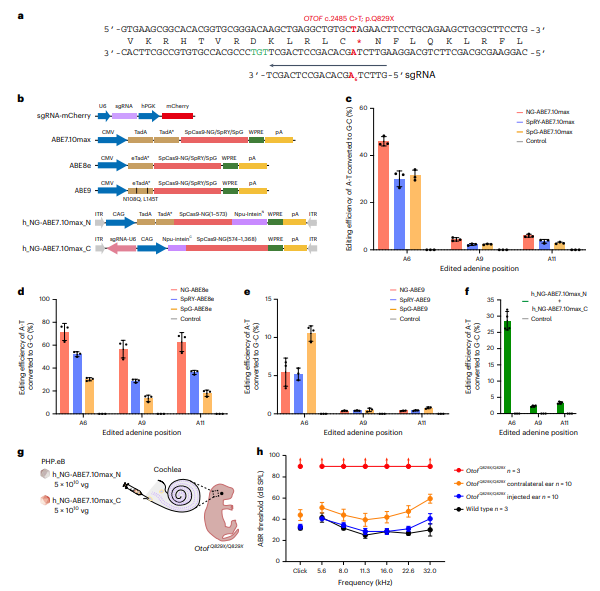
图7. 体外筛选人OTOF c.2485C>T . q829x最佳ABE及体内听力功能恢复
总而言之,本研究利用CAG启动子实现了碱基编辑,开发了一种具有临床价值的ABE治疗策略,为遗传性耳聋和其他疾病的治疗提供了新的前景。成功永久恢复了OtofQ828X/Q828X和OtofQ829X/Q829X小鼠的听力功能,为OTOF p.Q829X突变患者提供了潜在治疗方案。
原文链接:
https://www.nature.com/articles/s41551-024-01235-1
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#基因编辑# #遗传性耳聋#
58