中国科学技术大学尤业字/余跃/洪春雁研究团队《AM》:纳米原电池直接向癌细胞释放高活性电子有效消除肿瘤
2024-05-15 BioMed科技 BioMed科技
这种策略绕过了外部辐射激活增敏剂将能量或电子转移到氧分子的步骤,从而克服了光穿透不足、增敏剂活性低和缺氧肿瘤微环境中氧供应不足的限制。
外部刺激触发癌细胞中的化学反应,产生高活性或细胞毒性化学物质以杀死癌细胞,是癌症治疗的一种有前景的方法。例如,常见的治疗方法包括向实体肿瘤中给予治疗剂(增敏剂),然后进行局部非电离辐射,如光或超声波。光、超声等辐射激活增敏剂,将能量或电子传递给周围区域的氧分子或其他底物,生成细胞毒性活性氧种(ROS),这些活性氧种可以在对人体正常组织影响最小的情况下杀死癌细胞。此外,产生的ROS可以引发免疫反应,如免疫原性细胞死亡,激活先天和适应性免疫系统对抗肿瘤,进一步杀死癌细胞。尽管对这些疗法的极具潜力,但仍存在重大挑战,例如在肿瘤中生成足够的活性或细胞毒性化学物质受到外部光穿透深度差和肿瘤组织中氧供应不足的严重限制。通常,光在皮肤和组织中的衰减非常快;报道的结果显示,只有1%的450 nm光可以到达大约1.5 mm的深度,1%的650 nm光可以到达大约4.0 mm的深度。此外,辐射介导的活性或细胞毒性化学物种在癌细胞中的生成高度依赖于氧的供应;然而,肿瘤通常具有自然缺氧的微环境,无法提供足够的氧,使肿瘤对外部辐射介导的治疗产生抵抗。此外,治疗引起的氧消耗进一步加剧肿瘤缺氧,可能导致各种不良后果,如血管生成、恶化的肿瘤免疫抑制微环境,以及增加的肿瘤侵袭和转移。因此,触发癌细胞中各种化学反应,产生独立于氧气和外部辐射的高活性化学物种,对癌症治疗具有很大的吸引力;然而,迄今为止,这仍然非常具有挑战性。

基于以上,中国科学技术大学尤业字研究团队提出了一种从纳米原电池直接向癌细胞释放高活性电子的策略。这种策略绕过了外部辐射激活增敏剂将能量或电子转移到氧分子的步骤,从而克服了光穿透不足、增敏剂活性低和缺氧肿瘤微环境中氧供应不足的限制。金属的费米能级高于半导体材料的导带,金属的腐蚀可以产生电子,这些电子可以在没有外部辐射的情况下,通过“内建电场”的方式进一步转移到半导体材料的导带。因此,研究团队构建了一种新型纳米尺寸的原电池(NanoGC)。在肿瘤中,Ti0和Al0的腐蚀在纳米原电池的阳极材料中产生高活性电子,然后这些电子被转移到半导体阴极材料并释放到肿瘤组织中。这些释放的电子具有高活性,并与癌细胞中的各种周围(生物)分子(蛋白质、DNA、H2O2等)反应,不仅直接破坏这些生物分子,而且形成许多高活性和细胞毒性化学物质以根除肿瘤。值得注意的是,NanoGC的性能独立于氧气含量和外部能量照射。即使在严重缺氧的环境中(即1% O2),NanoGC仍然可以激活强烈的免疫反应,这对光动力治疗是一个挑战。NanoGC的独特功能为治愈的小鼠提供了长期保护,确保对潜在肿瘤复发的持续免疫监视。
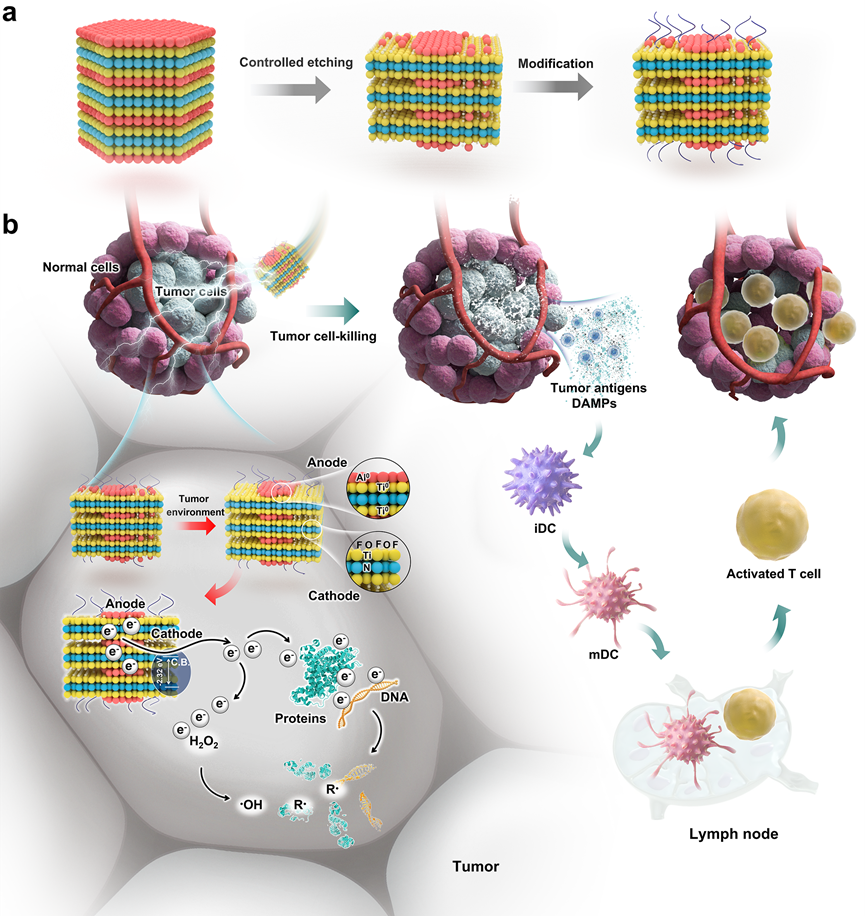
图1 NanoGC的治疗肿瘤的原理图
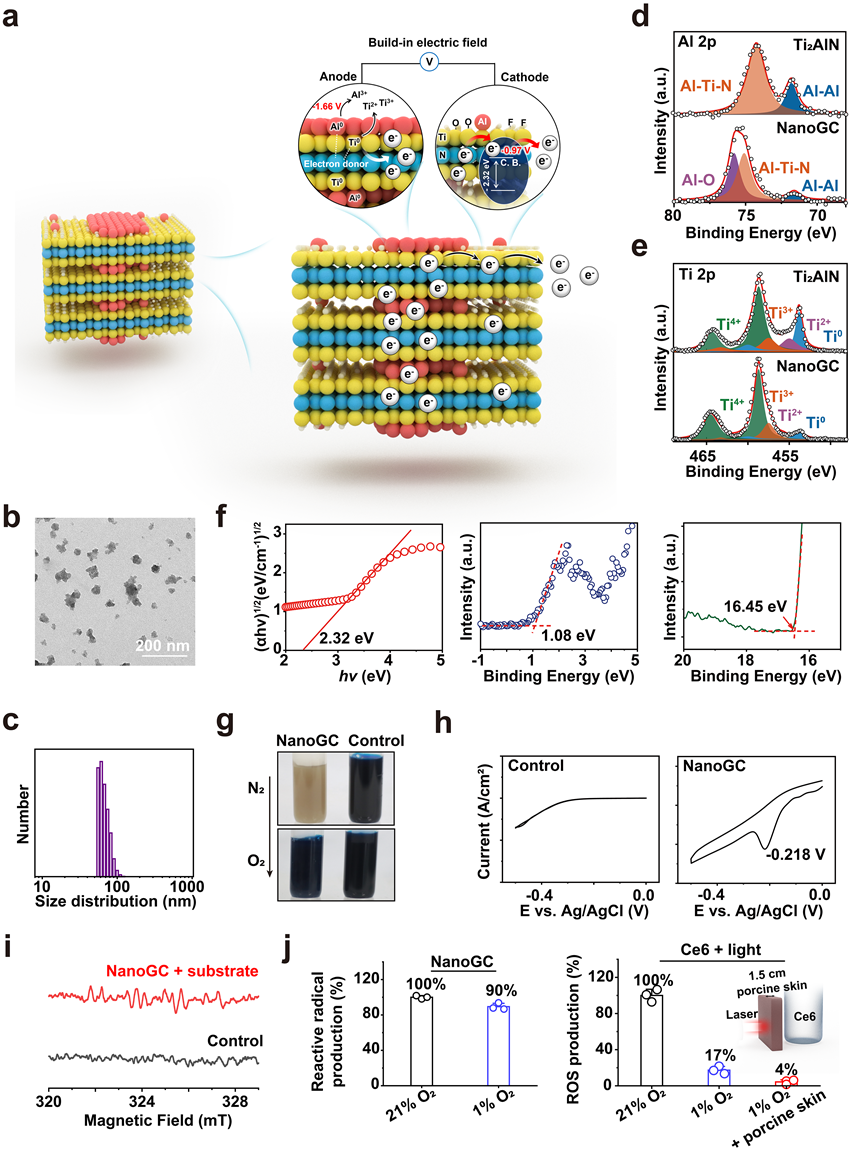
图2 NanoGC的制备、表征及理化性质研究
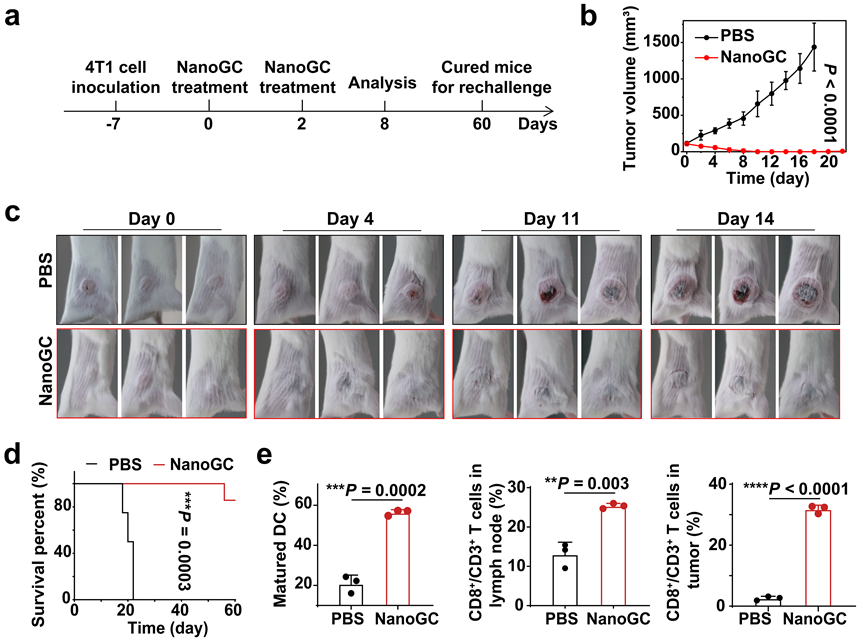
图3 NanoGC对皮下瘤治疗图
最终的动物实验结果显示,NanoGC治疗能显著消除肿瘤,并大大延长了小鼠的生存期(图3)。相关工作以“Nanogalvanic Cells Release Highly Reactive Electrons in Tumors to Effectively Eliminate Tumors”为题发表在Advanced Materials。论文第一作者为博士后黄伟强及2021级博士生朱涯旗,通讯作者为中国科学技术大学尤业字教授,中国科学技术大学附属第一医院余跃教授,中国科学技术大学洪春雁教授,博士后陈光,博士后高凡。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202404199
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#癌细胞# #纳米原电池# #高活性电子#
12