RBM10突变非小细胞肺癌患者的预后差,且与EGFR-TKI的晚期耐药相关
2024-09-16 苏州绘真医学 苏州绘真医学
研究 RBM10 突变与非小细胞肺癌关系,发现其与侵袭性疾病和不良预后相关,与不同突变组合影响各异,“实体瘤 1299 基因检测” 可覆盖相关基因。
据世界卫生组织WHO称,肺癌是全球癌症相关死亡的主要原因,但近十年来治疗取得了进展。下一代测序(NGS)的广泛使用已发现多种致病突变,包括RNA结合基序10(RBM10),它是调节前mRNA剪接的剪接体复合体的一部分。研究者利用电子病历创建了2018年至2023年期间接受治疗的RBM10突变NSCLC患者(50名患者)数据库,并获得了相应的IRB批准。为了进行亚组分析,研究者根据快速进展(定义为无进展生存期或中位反应持续时间早于每种治疗方式的相应临床试验)和疾病稳定将其分为不同组。
从治疗反应分析来看,RBM10突变人群的中位PFS为6.7个月,而匹配驱动突变的RBM10野生型人群的中位PFS为13.9个月。TP53突变在RBM10突变快速进展组中的发生率高于疾病稳定组。ZFHX3突变在RBM10突变疾病稳定组中的发生率更高。
RBM10突变与侵袭性疾病相关,治疗进展快于中位反应持续时间。RBM10突变患者同时发生ZFHX3和EGFR突变,与疾病更稳定相关,而同时发生KRAS和TP53突变则预示着疾病更具侵袭性。
-
RBM10参与前mRNA剪接的调节,在多种细胞周期调控通路中具有下游作用;
-
从单一机构患者群体来看,与对照组相比,RBM10突变患者的中位PFS更短;
-
KRAS和TP53与RBM10的共同突变会导致非小细胞肺癌的预后更差;
-
RBM10突变与EGFR突变非小细胞肺癌的晚期耐药性有关。
研究背景
肺癌是全球癌症死亡的主要原因。非小细胞肺癌(NSCLC)约占肺癌诊断的85%,进一步分为腺癌(78%)和鳞状细胞癌(18%)。虽然化疗仍然是治疗NSCLC的基石,但新型靶向疗法和免疫检查点抑制剂发挥了更大的作用,并最终延长了生存期。不幸的是,目前的疗法会产生耐药性。在使用TKI的靶向疗法中,耐药性要么通过靶向依赖性(酪氨酸激酶结构的变化阻止抑制)发生,要么通过靶外非依赖性(旁路信号通路上调)发生。免疫检查点抑制剂面临原发性耐药性(对治疗无反应)和获得性继发性耐药性(对治疗有初步反应后)的挑战。因此,促使人们研究这些复杂的耐药机制、耐药生物标志物以及克服这种耐药性的潜在方法。
NGS的广泛使用已发现了几种可能影响癌症进展和生长的致病突变。其中一种突变是RBM10,它是剪接体复合物的一部分,可调节前mRNA的剪接,从而促进选择性剪接,这是一种已知可产生促肿瘤基因的机制。研究表明,RBM10通过跳过外显子9来影响Notch调节基因NUMB的选择性剪接,从而阻止Notch受体的积累;外显子9在NUMB中的保留(促增殖)是肺癌中最常见的选择性剪接之一。涉及突变的RBM10和真核翻译起始因子 4H的额外剪接变异也导致肺腺癌细胞的肿瘤发生/增殖。在肺腺癌中发现了6个离散的突变,其中2个突变(1个错义突变和1个移码突变)导致功能丧失,但另外4个错义突变对mRNA剪接有改变作用。其他临床前研究表明, RBM10的敲低会增加小鼠肿瘤异种移植的生长。此外,RBM10在细胞凋亡中发挥作用,表现为在细胞系中暴露于高RBM10表达后肿瘤生长率受到抑制、Bcl-2蛋白表达水平降低、caspase-3和caspase-9表达水平增加。
从这些数据来看,RBM10确实是一种肿瘤抑制基因,但其普遍性会影响临床相关性。在对561名患者的TCGA数据库的分析中,35名肺腺癌患者有RBM10突变(6%)。研究对该突变组进一步分析发现,与野生型RBM10患者相比,157个与癌症发展途径和细胞增殖相关的基因更常在RBM10突变患者与RBM10共突变(P <.05)。从预后角度来看,RBM10突变与肺癌患者的生存率较差相关,RBM10突变的mRNA表达越高,生存率就越低。
RBM10与细胞周期调控通路:
由于细胞调节通路不能单独发挥作用,因此人们已经评估了RBM10与已知细胞调节通路的相互作用。最近的一项2023年研究发现,在肺癌细胞中,野生型RBM10与已知的原癌基因c-Myc结合,从而增加了其泛素依赖性降解。与之前发现的RBM10功能相反,该机制不涉及可变剪接,而是通过与核糖体蛋白uL18和uL5的相互作用作为c-Myc负反馈机制的一部分。此外,RBM10通过与MDM2-MDMx通路相互作用在p53调节中发挥作用;具体而言,未突变的RBM10表达增加可触发p53依赖性细胞凋亡并减少MDM2介导的p53破坏。其他研究发现,RBM10通过参与RAP1/AKT/CREB通路来抑制细胞增殖,该通路独立于MAPK/ERK信号传导。此外,有证据表明RBM10通过调节血管内皮生长因子(VEGF)参与血管生成。
鉴于RBM10在肺腺癌中普遍存在,其与EGFR的相互作用备受关注,并具有潜在的临床意义。在EGFR突变的肺腺癌小鼠模型中,RBM10或p53的缺失通过已知的促癌途径中的类似基因表达变化导致肿瘤生长。此外,RBM10的缺失增加了EGFR突变肺癌细胞中剪接体抑制的敏感性,从而导致EGFR TKI耐药性,但添加剪接体抑制剂可恢复对EGFR TKI的敏感性。另一项研究在患者来源的EGFR突变肿瘤模型中也发现了类似的结果,因为RBM10的缺失导致了EGFR抑制剂的耐药性。提出的机制涉及凋亡调节剂Bcl-x的选择性剪接,因为RBM10的敲除降低了促凋亡Bcl-xS与抗凋亡Bcl-xL的比例。此外,抑制Bcl-xLEGF可克服肺癌细胞中RBM10缺失介导的耐药性。RBM10介导的EGFR耐药性可能与EGFR靶内耐药性无关,因为在一项EGFR突变肿瘤研究中发现,90%以上的RBM10突变没有相关的靶内突变(T790M、C797S或MET扩增)。有趣的是,与“驱动”EGFR突变相比,RBM10突变更常见于亚克隆,并且据报道,在约5%的EGFR突变病例中,RBM10突变和EGFR突变同时出现。
研究结果
RBM10与疾病进展:
研究者评估了50名RBM10突变NSCLC患者的治疗和后续治疗反应。研究者将RBM10突变队列与同一时间在COH就诊的50名非RBM10突变NSCLC患者进行了比较,这些患者的EGFR和KRAS突变比例相等。RBM10突变队列的中位PFS为6.7个月(95%CI [4.5, 17.1]),而非突变队列的中位PFS为13.9个月(95%CI [10.4, 24.2])(图1 A)。值得注意的是,许多病情进展迅速的患者病情进展的时间早于5个月。最近的一项研究评估了RBM10的表达对早期淋巴结阳性EGFR突变NSCLC手术结果的影响,发现RBM10高表达组的5年OS低于低表达组,分别为71.5%和89.4%,P=0.020。为了进行额外的预后考虑,研究者将RBM10突变人群分为疾病快速进展组(定义为PFS/DFS(无病生存期)早于相应的临床试验,采用Flaura、GEOMETRY mono1、Checkmate 227、Keynote 024、Keynote 189的PFS,以及ALKA-372-001、STARTRK-1和STARTRK-2的联合分析作为系统治疗的基准)和疾病稳定组。虽然众所周知,临床试验的生存结果优于真实世界中的患者,但这种比较可作为广泛患者群体反应的进一步标志,但应谨慎解读。在50名RBM10突变患者中,71%的患者(20/28)疾病进展迅速,8名疾病稳定。其余22名患者要么失访(1名患者),要么接受治疗的时间不够长,无法确定早期进展与疾病稳定(21名患者)。
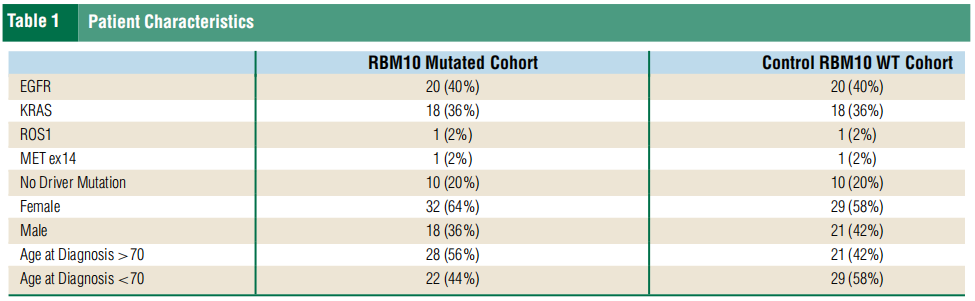
表1
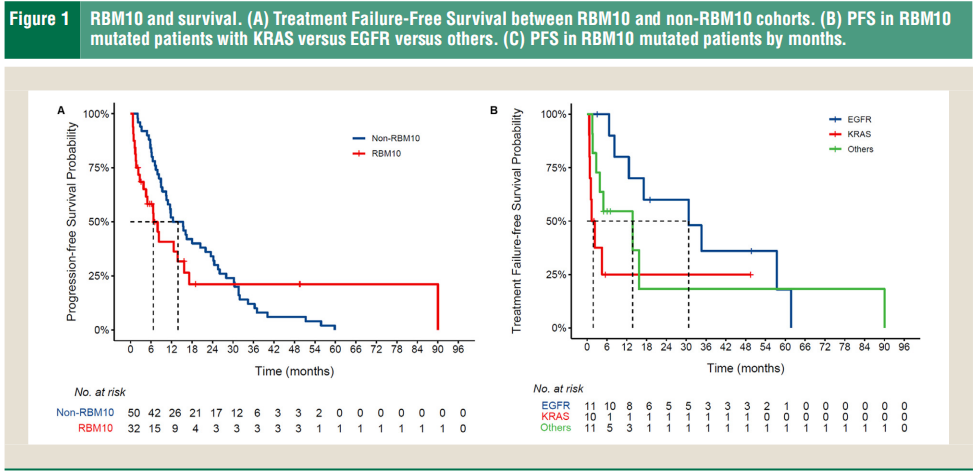
图1
RBM10和驱动突变:
研究者分析了RBM10突变和驱动突变(如表2所示)。在患者数据库中,50名出现RBM10的患者中有20名(40%)出现 EGFR突变,18名出现KRAS突变(10名KRAS G12C),4名出现其他驱动突变(MET ex14、ROS1、BRAF V600E),其余8名患者没有已知的驱动突变。在亚组分析中,在20名快速进展的患者中,12名出现其他驱动突变(4名EGFR、6名KRAS、1名MET ex14 和1名ROS1)。相反,在疾病稳定的8名患者中,有6名出现EGFR突变(L858R或外显子19)。虽然其他研究表明RBM10突变会促进EGFR耐药,但从本研究的数据来看,EGFR突变似乎更具保护性,可使病情稳定时间更长。RBM10突变患者的PFS或治疗无失败生存期和OS因同时存在的驱动突变而异,与同时存在KRAS突变的患者相比,同时存在EGFR突变的患者有显著改善(图1 B、C)。根据研究者分析,RBM10突变通常在疾病过程中较晚出现,而驱动突变则出现较早,这与之前的数据相吻合,即RBM10突变比驱动突变更常为亚克隆。此外,RBM10突变通常在进展时发生,并且至少在EGFR突变的NSCLC中可能是靶外耐药的机制(图2)。
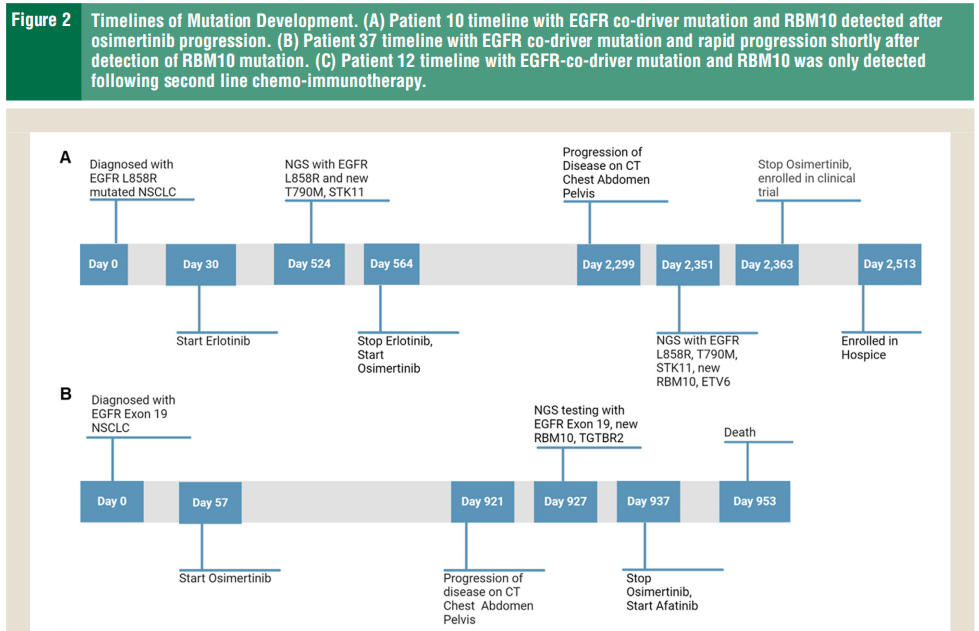
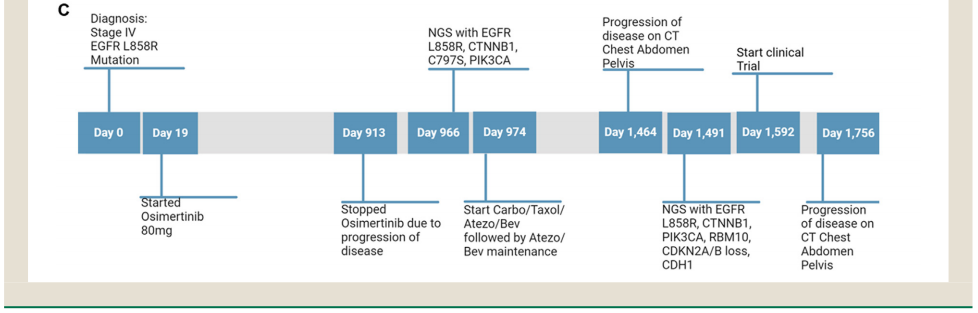
图2
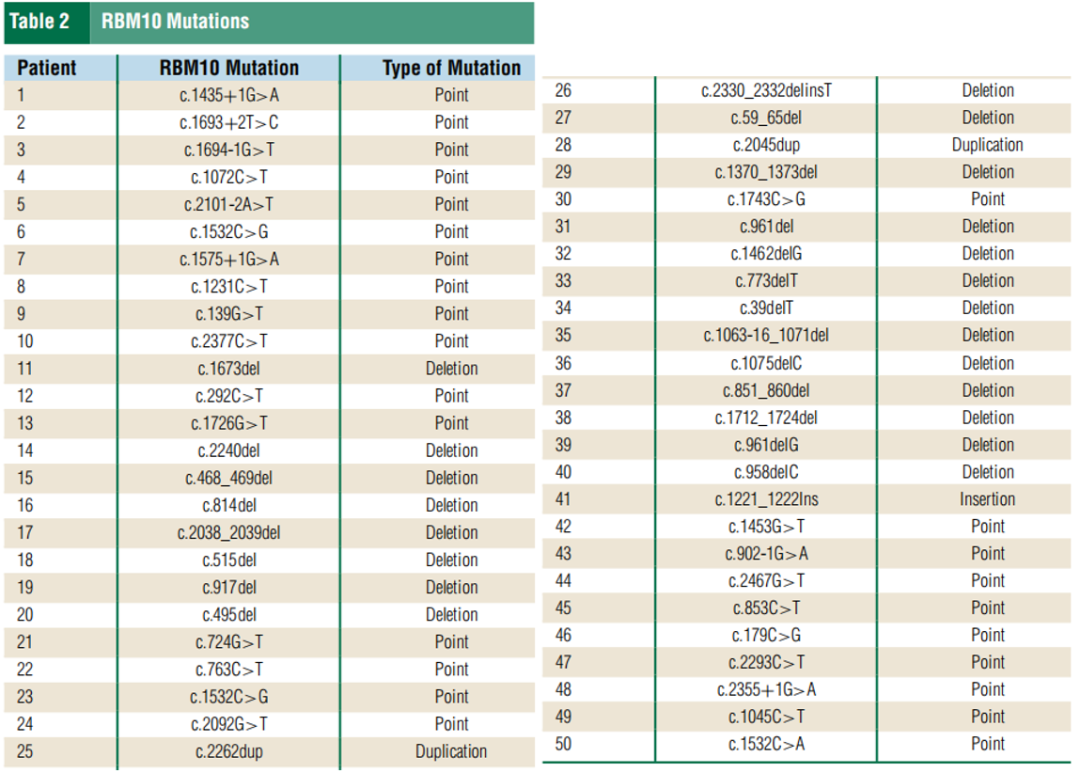
表2
RBM10与肿瘤突变负荷:
研究者还评估了RBM10突变与突变负荷之间的关联。RBM10突变似乎与MSI稳定性的变异无关,因为所有患者都患有MSI稳定疾病。肿瘤突变负荷(TMB)变化较大,17名患者TMB中等,3名TMB高,其余30名TMB低。所有3名TMB高患者的病情进展迅速。这与之前的研究相关,之前的研究发现RBM10突变肺腺癌与免疫活性增加有关,免疫细胞浸润、免疫细胞和HLA表达较高。Fisher精确检验的结果显示,在此RBM10突变队列中,肿瘤突变负荷与临床反应之间没有关系(优势比(OR) = 1.33,95 CI 0.24-7.35,p=0.741)(图3)。
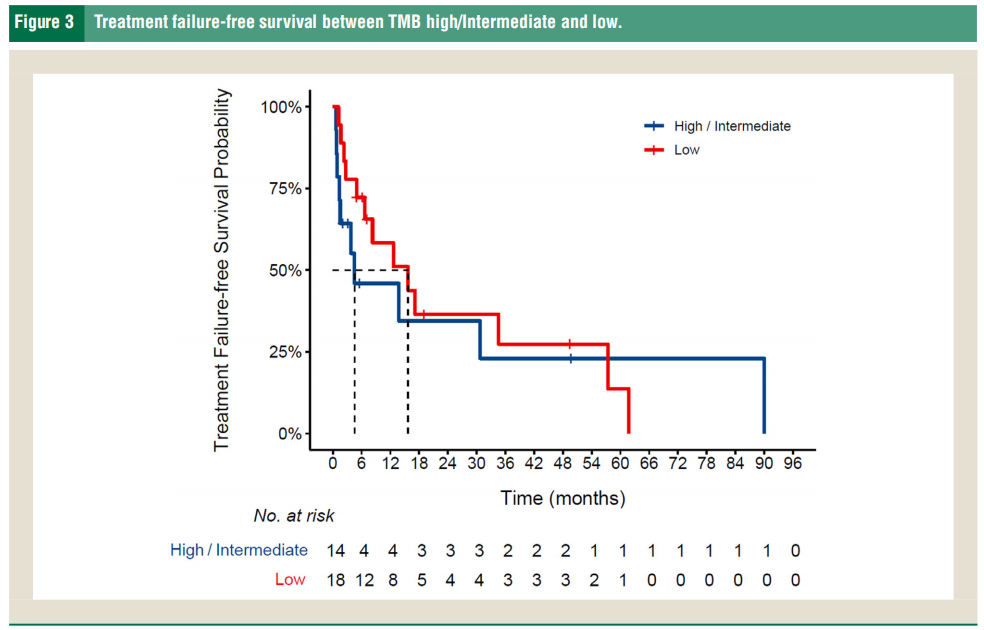
图3
RBM10和非驱动突变:
先前的研究显示,RBM10已被证明与多种细胞功能途径相互作用,因此其他突变的影响可能会加剧或减弱RBM10突变的影响。研究者评估了患者群体中具有病理学意义但非驱动因素的突变。所有患者中最常见的非驱动突变基因是TP53、CDK4、CDKN2A/CDKN2B和 PIK3CA(图4)。TP53突变在快速进展组中的发生率高于疾病稳定组(优势比(OR) 8.232,95%CI [0.761, 448.35],P = 0.0791)。虽然p值在统计学上并不显著,但TP53突变的已知负预后和RBM10与TP53的已知相互作用确实具有临床意义。
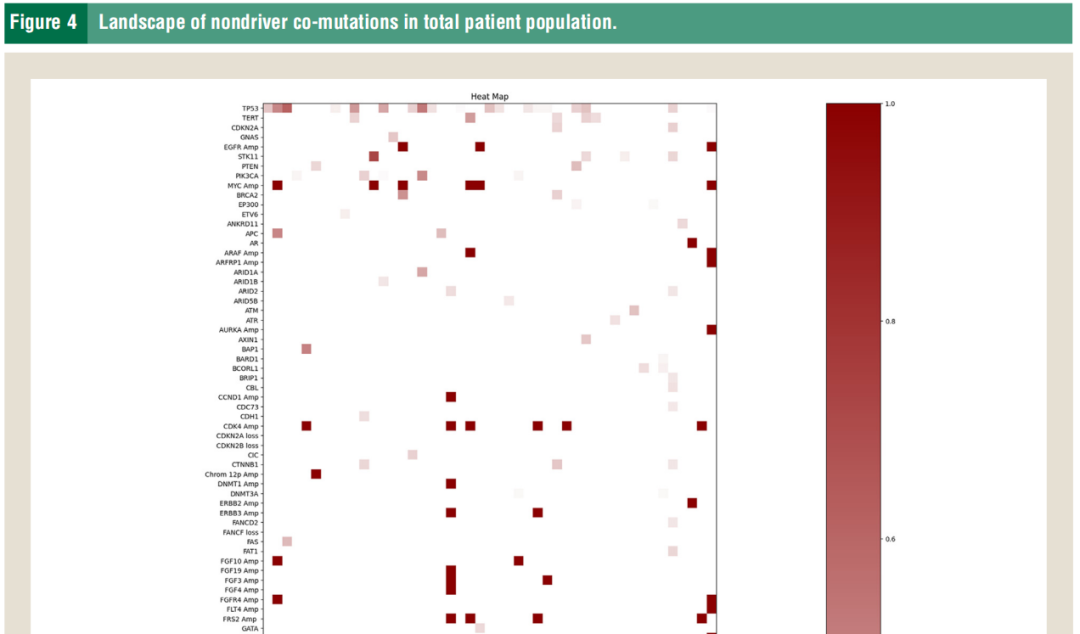
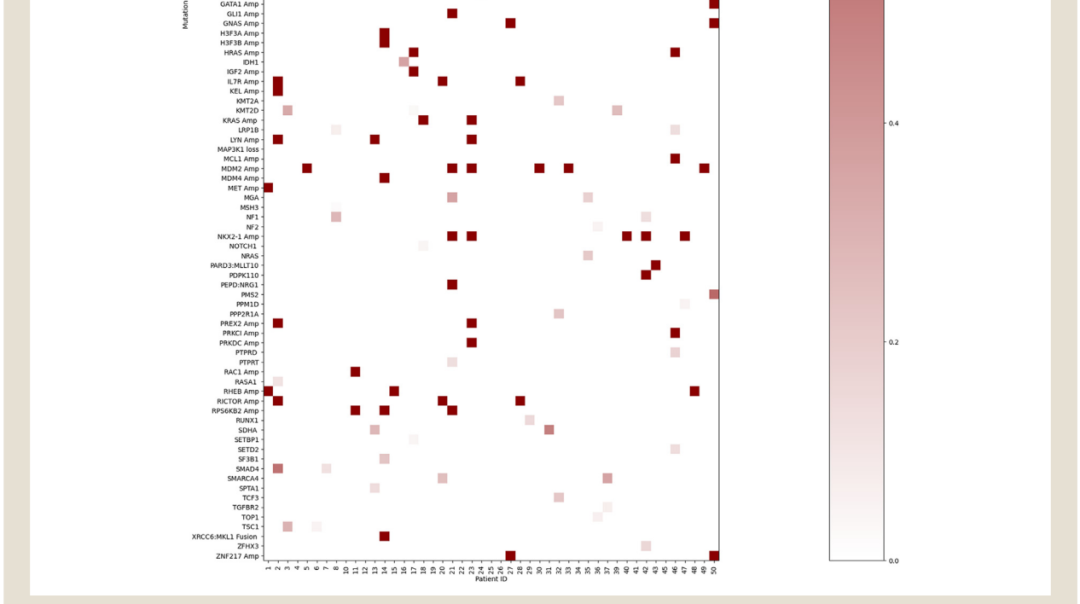
图4
RBM10和意义不明变异:
随着NGS技术的进步,越来越多意义不明的基因变异被发现,有些甚至是在最初检出后才被发现具有病理性。在本研究的RBM10突变患者群体中,最常见的意义不明变异(VUS)是SPTA1、KMT2C和ZFHX3(图5)。ZFHX3突变和PMS2扩增在疾病稳定组中的比例高于快速进展组,这表明ZFHX3和PMS2扩增与临床结果之间存在统计学上显著的相关性[优势比(OR) 0.049,95%CI [0.001, 0.629],P值分别为0.0069和0.02767。
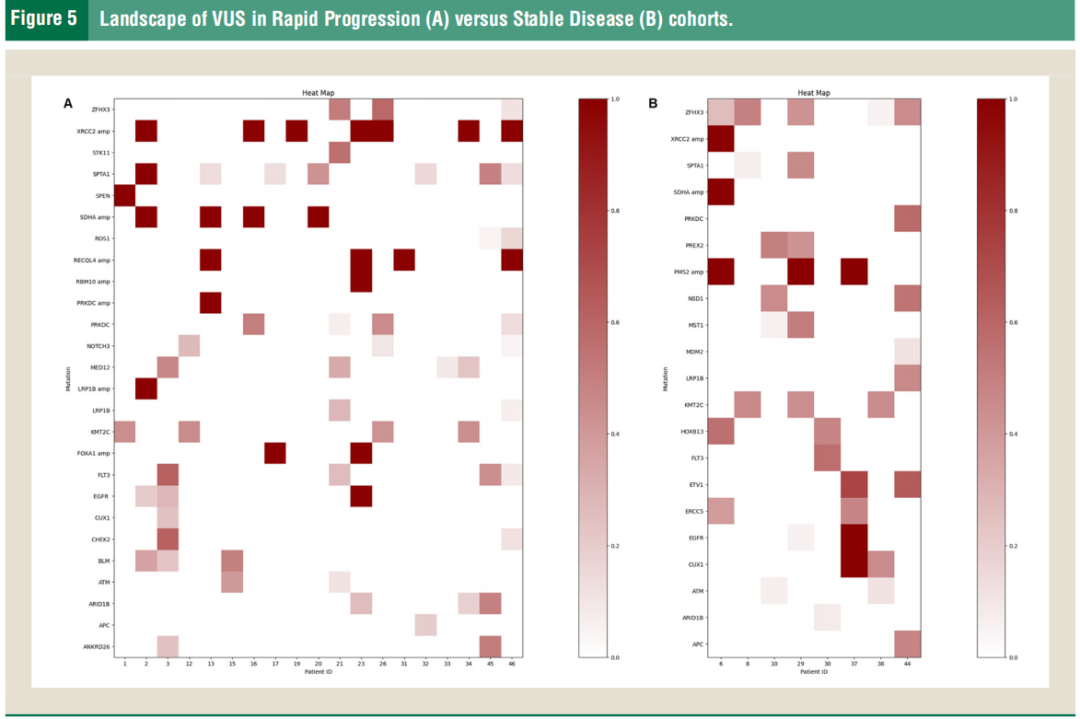
图5
值得注意的是,突变体ZFHX3已被证明与接受免疫检查点抑制剂治疗的NSCLC中的总体生存率(OS)增加以及TMB和新抗原负荷更高相关,从而对免疫检查点抑制剂产生有利反应。即使ZFHX3突变与TP53突变同时发生,与TP53的其他共突变组合相比,OS仍然显著改善。尽管PMS2中的几种胚系突变与林奇综合征有关,但对于体细胞变异的了解较少。根据研究者的分析,MSI-H患者或TMB-H患者均未出现PMS2扩增。
结论/讨论
由于之前的信息有限,本研究旨在确定RBM10突变在NSCLC中的临床相关性。从这些回顾性观察数据来看,RBM10确实与更具侵袭性的疾病和更差的总体预后有关,大多数患者的疾病进展迅速。RBM10与几种已知的主要细胞周期调节通路有复杂的分子相互作用,但从分析中发现了一些新的分子机制。当RBM10突变与ZFHX3突变同时发生时,这与病情稳定有关。虽然ZFHX3已被证明是NSCLC的预后正相关生物标志物,但确切机制尚不清楚,之前也没有观察到ZFHX3和RBM10之间的相互作用。因此,进一步评估两种分子之间的相互作用可以对这一领域提供进一步的了解。
在这个RBM10突变肺癌人群中,EGFR突变与RBM10同时发生时似乎具有一定的保护作用,尽管先前的研究有临床前证据表明RBM10突变通过多种机制导致EGFR耐药性。对于这种差异的一种解释是,通常RBM10突变在EGFR突变之后发生,因此突变的影响可能要等到患者病情稳定并对EGFR TKI产生足够反应后才能显现。RBM10突变的发生似乎是EGFR突变的非小细胞肺癌晚期耐药(随后是更快速的疾病进展)的一种机制,如上述一小部分患者的突变时间表所示。相反,在本队列中的KRAS突变NSCLC中,RBM10突变似乎在病程早期发生,从而导致早期治疗耐药。一个潜在的混杂因素是,与EGFR突变(包括罕见突变)NSCLC相比,KRAS突变NSCLC的总体预后更差,多项试验的中位PFS明显较低。在多家机构对具有驱动突变的RBM10突变肺癌进行调查可以提供更多见解。
虽然本研究注意到Bcl-2通路蛋白的变异比例很小,但RBM10在该通路中的参与已得到大量研究,甚至显示出对EGFR TKI耐药性的影响。鉴于这些临床前数据,EGFR和RBM10突变的肺癌患者可能受益于靶向Bcl-2通路的治疗。此外,进一步研究RBM10及其与TP53的相互作用以及其与MDM2的调节作用,将为我们关于TP53与RBM10同时存在以及疾病快速进展的数据提供进一步的临床相关性。有必要对RBM10进行更多研究,以进一步证明其作为生物标志物的相关性。
值得说明的是,我司的“实体瘤1299基因检测”项目覆盖了RBM10基因的所有编码区(CDS),且包含上文提到的重要共突变基因EGFR、KRAS、TP53和ZFHX3等,指导患者靶向、免疫和化疗用药,评估预后和遗传风险!
参考文献:
Reyes A, Afkhami M, Massarelli E, et al. RBM10 Mutation as a Potential Negative Prognostic/Predictive Biomarker to Therapy in Non-Small-Cell Lung Cancer. Clin Lung Cancer. Published online July 23, 2024. doi:10.1016/j.cllc.2024.07.010

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#非小细胞肺癌# #RBM10#
9