WCLC 2024 | 对话David Lee:探索EGFR与MET双重阻断在非小细胞肺癌治疗中的新突破
2024-09-18 MedSci原创 MedSci原创
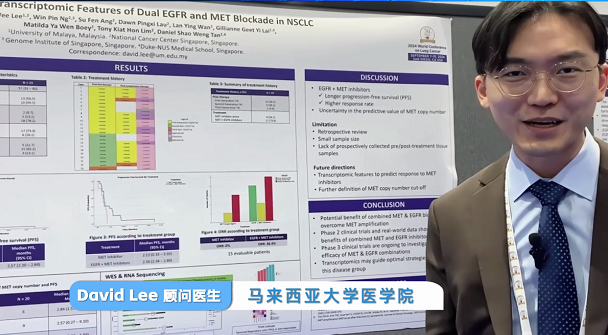
梅斯医学邀请到了来自马来西亚大学医学系的资深临床肿瘤学家David Lee分享他在这一领域的最新研究成果和见解。
非小细胞肺癌(NSCLC)作为全球范围内最常见且极具挑战性的恶性肿瘤之一。EGFR突变是NSCLC最常见的驱动基因之一,特别是在亚洲人群中,此类突变的发生率较高。近年来,针对表皮生长因子受体(EGFR)突变的非小细胞肺癌(NSCLC)患者,靶向治疗取得了显著的进展。靶向药物通过抑制EGFR信号传导通路中的异常活性,阻止癌细胞的增殖和扩散,从而有效地延长了患者的生存期,提高生活质量。尽管靶向治疗带来了显著的临床益处,但耐药问题仍然是一个难以逾越的挑战。
尽管最初对EGFR抑制剂有响应,许多患者最终会发展出耐药性。其中,一种耐药机制涉及MET信号通路的激活,这表明同时阻断EGFR和MET可能克服或延迟耐药性的出现,并提高治疗效果。近期,2024年世界肺癌大会(WCLC 2024)在美国圣地亚哥会议中心隆重召开。梅斯医学邀请到了来自马来西亚大学医学系的资深临床肿瘤学家David Lee分享他在这一领域的最新研究成果和见解。
梅斯医学:请您介绍一下您在会议上的发表的相关研究?
David Lee:EGFR突变是肺癌中最常见的驱动基因之一,尤其在东亚人群中更为普遍。针对EGFR突变的酪氨酸激酶抑制剂(TKIs)已经成为EGFR突变肺癌患者的一线治疗选择,并显著提高了患者的无进展生存期和总生存期,同时也改善患者的生活质量。
然而,尽管初始治疗反应良好,几乎所有接受EGFR TKI治疗的患者最终都会发展出获得性耐药,导致疾病进展。MET基因扩增被认为是EGFR TKI治疗后出现耐药的一种重要机制。MET是一种受体酪氨酸激酶,当其表达水平增加时,可以激活下游信号通路,如PI3K/AKT和RAS/MAPK途径,从而促进细胞增殖和存活,导致肿瘤细胞对EGFR抑制剂的抵抗。
为了应对由MET扩增导致的耐药问题,我们已经开始探索EGFR与MET双重阻断的策略。这种联合治疗的目标是在抑制EGFR的同时,也阻止MET介导的信号传导,从而克服耐药并增强抗癌效果。
梅斯医学:在您的研究中,您是如何评估EGFR与MET双重阻断治疗的效果的?
David Lee:我们通过对新加坡肺癌联盟数据进行回顾性分析,评估在接受EGFR抑制剂治疗后出现MET扩增的NSCLC患者在接受EGFR与MET双重阻断治疗后的无进展生存期和治疗响应率。初步结果令人鼓舞,数据显示,在接受EGFR与MET双重阻断治疗后,患者的无进展生存期得到了显著延长,这意味着从开始治疗到疾病再次进展的时间间隔有所增加,同时治疗响应率也有所提高。
尽管初步结果非常积极,但仍需更大规模的前瞻性临床试验来验证这些发现,并进一步确定最佳的治疗方案、剂量以及给药时间。此外,还需要评估该联合疗法的安全性,特别是关注可能的副作用和毒性。总之,EGFR与MET双重阻断为治疗非小细胞肺癌提供了新的希望,特别是对于已经对单药EGFR抑制剂产生耐药的患者。随着研究的深入,我们期待这一治疗策略能够为患者带来更多益处,并推动肺癌治疗领域的发展。
梅斯医学:在进行这项研究时,您和您的团队遇到了哪些挑战?
David Lee:在研究的过程中,我们确实面临着一些重要的挑战。首先,由于本研究采用的是回顾性设计,这本身就带来了一些固有的局限性。回顾性研究通常依赖于现有的医疗记录,这些记录可能不够完整或者一致性不高,这可能会影响研究结果的准确性。此外,由于样本量相对较小,这使得我们的研究结果可能无法完全反映更广泛患者群体的情况,进而限制了研究结果的普遍适用性。另一个关键的挑战是我们缺乏前瞻性收集的治疗前后组织样本。这种样本对于深入理解治疗效果以及识别可能的耐药机制至关重要。没有这些样本,我们难以全面评估治疗前后的分子变化,也无法精准地鉴定出哪些生物标志物与治疗响应相关联。
为了解决以上挑战,我们将运用转录组学技术来分析患者在接受MET抑制剂治疗前后的基因表达模式。这种方法可以帮助我们识别出可能预测治疗响应的基因标志物,从而为患者提供更加个性化的治疗方案。同时,为了提高治疗效果的预测精度,我们还将致力于明确MET基因拷贝数的临界值。此外,为了克服回顾性研究的局限性,我们计划开展前瞻性研究,系统地收集患者的临床数据和生物样本。这将允许我们更加全面地评估治疗效果,并深入了解治疗过程中发生的生物学变化。
梅斯医学:您对EGFR与MET双重阻断治疗策略的前景有何看法?
David Lee:尽管目前的数据还不足以支持EGFR与MET双重阻断疗法在临床中的广泛应用,但已经有一些研究表明这种联合疗法具有潜在的价值。在II期临床试验和真实世界研究中,已经观察到了这种治疗方案对特定患者群体的有效性,尤其是在那些已经对传统EGFR抑制剂产生耐药性的患者中。
随着研究的推进,特别是正在进行的III期临床试验,我们期待能够获得更高质量的数据来进一步验证这种治疗策略的有效性和安全性。III期临床试验通常涉及更大的患者样本量,更严格的研究设计,并且会在多个中心进行,这将有助于我们更全面地评估治疗效果,并确定哪些患者最有可能从中受益。
因此,尽管现阶段仍有许多未知因素,但我相信随着科学的进步和临床研究的深入,EGFR与MET双重阻断疗法将逐渐展现出其作为非小细胞肺癌治疗新策略的巨大潜力。这不仅有望改善患者的治疗结果,还有助于推动个性化医疗的发展,使更多患者能够受益于最新的研究成果。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#非小细胞肺癌# #WCLC 2024# #EGFR与MET双重阻断#
0