Lancet Oncol:经皮雌激素治疗前列腺癌可减少并发症的发生
2013-03-07 echo1166 DXY
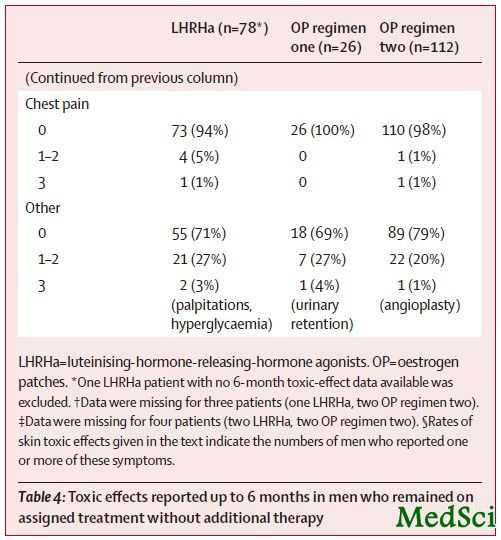
6个月时研究者所报道的毒性反应 应用促黄体激素释放激素激动剂(LHRHa)治疗前列腺癌患者通常会带来包括骨质疏松在内的长期毒性反应。采用肠外雌激素治疗不仅能避免这种与LHRHa相关的长期并发症的干扰,也能避免与口服雌激素相关的血栓栓塞并发症的产生。为了针对上述问题进行研究,来自英国MRC临床研究中心的Ruth E Langley等针对上述问题进行了相关研究,他们的研究结果发表在Lancet

作者:echo1166
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#并发#
45
#Lancet#
65
#雌激素治疗#
58
#Oncol#
65
#激素治疗#
60