Front aging neurosci:自噬与 NLRP3 炎症小体在阿尔茨海默病和帕金森病中的相互作用
2022-10-19 brainnew神内神外 brainnew神内神外
自噬是一种标准且受到严格调控的细胞自我降解过程,负责吞噬受损的细胞器、错误折叠的蛋白质和侵入称为自噬体的双层膜中的病原体,并引导它们进行溶酶体降解,自噬在体内的新陈代谢和能量平衡中起着至关重要的作用。
自噬是一种标准且受到严格调控的细胞自我降解过程,负责吞噬受损的细胞器、错误折叠的蛋白质和侵入称为自噬体的双层膜中的病原体,并引导它们进行溶酶体降解,自噬在体内的新陈代谢和能量平衡中起着至关重要的作用。
研究发现,当自噬发生变化时,细胞内受损细胞器和异常折叠蛋白的异常积累会导致不可逆的损伤。大量研究证实,自噬功能和病理蛋白在神经退行性疾病的发展中相互作用。在大多数自噬溶酶体疾病中,大脑往往是受影响最严重的器官,神经元严重依赖自噬来维持正常功能和体内平衡,这表明自噬在神经元健康中起着至关重要的作用。迄今为止,自噬功能障碍已被证明会诱导神经退行性变并加剧疾病进展。然而,自噬在神经退行性疾病发展中的具体机制仍不清楚。因此,有必要在生理相关范围内进一步探索自噬在神经退行性疾病中的调控作用。本篇综述旨在回顾近年来关于自噬、NLRP3炎症小体和蛋白聚集体在阿尔茨海默病(AD)和帕金森病(PD)中相互作用的研究,分析其作用机制,为今后的进一步研究提供理论参考。

研究结果
1、NLRP3炎性体
NLRP3 是 NLR 受体家族中最具特征的炎症小体,在免疫细胞中广泛表达,它在机体防御病原体入侵中发挥作用。此外,它还能感知受损蛋白质,例如错误折叠或聚集的 Aβ 或 α-突触核蛋白,这些蛋白质可能与 AD、PD 和其他神经退行性疾病有关。NLRP3 炎性小体通常由三部分组成:NLRP3 传感器蛋白 (一种模式识别受体 (PRR),充当传感器分子),衔接蛋白 ASC(一种凋亡相关SPECK样蛋白,包含半胱天冬酶激活和募集结构域)和 procaspase-1(作为效应分子发挥作用)。NLRP3 炎性体的免疫受体通过转录因子核因子-κ轻链增强子激活的 B 细胞 (NF-κB) 以模式识别受体 (PRR) 依赖性方式对 PAMP 和 DAMP 作出反应,触发 pro-IL-1β、pro-IL-18 的表达,并通过激活 caspase-1 和诱导炎症来促进 IL-1β 和 IL-18 的成熟和分泌。NLRP3炎性体的引发和激活机制如图1所示。

图1 NLRP3炎性体的启动和激活机制
2、自噬与 NLRP3 炎症小体在神经退行性疾病中的相互作用
近年来,研究表明,神经元中蛋白质的异常折叠和积累是大多数神经退行性疾病的共同特征之一。虽然自噬有助于清除受损的细胞器、蛋白质聚集体或脂滴,但这些通常是未经加工的有毒物质,在很大程度上,它们可能导致正常的细胞功能障碍,自噬通量减少进一步导致自噬缺乏或功能障碍。最近,一项研究发现,路易体中 α-突触核蛋白的积累可能是由于伴侣介导的自噬和溶酶体功能障碍导致缺乏蛋白质清除。。细胞调节机制的失败可以进一步降低蛋白酶体降解的异常聚集蛋白的速率,并导致异常神经毒性蛋白(包括 tau 和 α-突触核蛋白)在细胞内大量积累。中枢神经系统感染、脑损伤、AD和多发性硬化患者的脑脊液、脑组织和血浆中存在高水平的IL-1β和IL-18,并且NLRP3蛋白表达增加与高IL- 1β与血清IL-18水平相关,这表明NLRP3炎症小体激活参与了神经系统疾病的病理过程。此外,研究进一步发现,IL-1β和IL-18分别与神经胶质细胞、神经元、巨噬细胞和内皮细胞上表达的受体结合,启动一系列复杂的信号事件,导致中枢神经系统发生炎症。因此,神经元自噬的精准调控意义重大,与神经炎症和脑组织中的许多聚集蛋白密切相关。神经退行性疾病中自噬与NLRP3炎性体的串扰机制如图2所示。
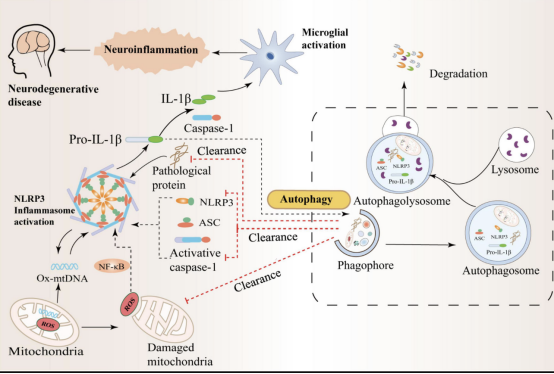
图2 神经退行性疾病中自噬与 NLRP3 炎性体之间的串扰
综上所述,自噬是影响神经元健康的重要机制,它通过调节溶酶体功能清除神经系统中异常折叠的蛋白质来维持正常的神经元功能。然而,当自噬受损或自噬通量减少时,蛋白质聚集体的不完全清除会导致线粒体损伤、活性氧生成、溶酶体破坏和体内组织蛋白释放. 另一方面,许多蛋白质聚集体和细胞内释放因子可以进一步激活 NLRP3 炎性体诱导神经炎症。
神经炎症是一把双刃剑,在急性感染过程中起到防御机制的作用,具有抗感染作用。然而,进入慢性炎症期后,细胞毒因子的过度释放会导致炎症激活,从而加剧细胞损伤和神经退行性变。因此,过度活化的 NLRP3 炎性体反过来又会加剧病理并加速神经源性疾病的进展。
参考文献
Lu R, Zhang L and Yang X (2022) Interaction between autophagy and the NLRP3 inflammasome in Alzheimer’s and Parkinson’s disease. Front. Aging Neurosci. 14:1018848. doi: 10.3389/fnagi.2022.1018848.
原文链接:https://www.frontiersin.org/articles/10.3389/fnagi.2022.1018848/full?utm_source=BN-AT25&utm_medium=wechat&utm_campaign=chinaad
编译作者: 原代美少女 (Brainnews创作团队)
校审: Simon (Brainnews编辑部)
作者:brainnew神内神外
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言