最新Nature:揭秘抗癌神器干扰素-ε对卵巢癌的作用机制
2023-08-18 BioMed科技 BioMed科技
IFNε能够激活抗肿瘤的T细胞和自然杀伤细胞,并防止髓源性抑制细胞和调节性T细胞的积累和活化。
卵巢癌在美国每年约有2万新病例,治疗面临着严重的未满足需求。卵巢癌是一种异质性疾病,包括不同的亚型,其中最常见的是高级别浆液性卵巢癌(HGSOC)。由于缺乏有效的筛查手段和模糊的腹部症状的主导,许多女性出现了广泛的腹膜沉积物和恶性腹水。干扰素-ε(Interferon-ε,简称IFNε)是唯一在女性生殖道上皮细胞中常规表达的肿瘤抑制因子,能够限制卵巢癌的发展。IFNε似乎已经在保护女性生殖道免受感染以及防止卵巢癌的发展、建立和晚期阶段方面发挥了作用。因此,需要基于对其发病机制的新认识来指导新的治疗方法。
2023年8月16日,哈德逊医学研究所的通讯作者Paul J. Hertzog博士等人,在多种临床前模型中表征了IFNε的抗肿瘤活性,并通过操纵IFNε受体IFNAR1在不同细胞区域的表达、不同程度的IFNε暴露以及全局的IFN信号测量,证明了IFNε的抗肿瘤机制涉及其直接作用于肿瘤细胞,并且至关重要的是激活了抗肿瘤免疫——IFNε能够激活抗肿瘤的T细胞和自然杀伤细胞,并防止髓源性抑制细胞和调节性T细胞的积累和活化。该论文以Interferon-ε is a tumour suppressor and restricts ovarian cancer为题,发表在Nature期刊上。论文第一作者是哈德逊医学研究所的Zoe R. C. Marks博士。

【IFNε的表达和丧失特点】
为了确认IFNε是否与肿瘤生成相关,他们首先在高级别浆液性卵巢癌(HGSOC)中确认了IFNε的内源性表达,并且找到了起源细胞——FT15的分泌上皮细胞(SEC)。免疫组织化学染色显示,健康女性的FT上皮细胞中存在IFNε表达。然后,研究者发现IFNε在癌症中的表达显著减少。在LGSOC和HGSOC患者中,IFNε的表达水平明显下降。通过组织芯片阵列和转录组数据的分析,研究者证实了在肿瘤样本中FT中的IFNε表达减少。这种独特的IFNε表达模式、在癌症中的减少以及老年女性中的低表达水平,都表明IFNε可能具有抑制肿瘤生成的潜力。为了支持这一假设,研究者选择了人类HGSOC细胞系CaOV3和OVCAR4,证明了重组人IFNε具有抗增殖活性,可以延长细胞倍增时间。研究发现,IFNε是卵巢癌发展中一个重要的潜在抑制因子。在高级别浆液性卵巢癌的起源细胞——输卵管上皮细胞中,IFNε被常规表达,但在肿瘤发展过程中逐渐丧失。
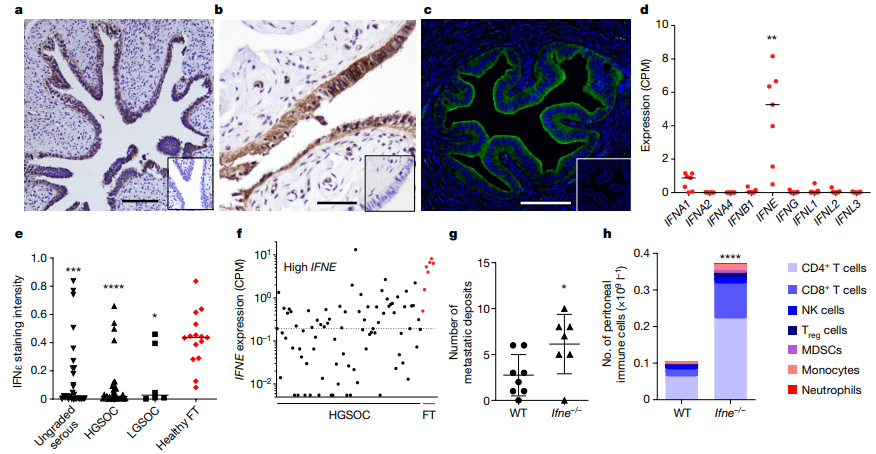
图1 HGSOC中上皮IFNε的抑制和抗肿瘤特性
【IFNε的抗肿瘤活性】
为了证明IFNε在体内具有抑制肿瘤活性,研究者使用卵巢癌细胞系ID8建立了原位同基因HGSOC的临床前模型。结果显示,Ifne−/−小鼠相对于野生型小鼠在肿瘤注射后的六周内,腹腔内肿瘤扩散和转移生长显著增加。研究者还观察到,内源性IFNε的缺失导致某些腹腔免疫细胞群的总数升高。这些发现表明IFNε具有内源性肿瘤抑制剂的特点。
为了进一步了解IFNε的抗肿瘤特性和机制,研究者在不同临床前模型中研究了重组IFNε的效果。在原位同基因ID8模型中,注射重组小鼠IFNε显著抑制了腹腔转移肿瘤的生长,这种抑制与剂量呈正相关。同时,研究者还观察到IFNε能够抑制正在发展的肿瘤,特别是在腹腔转移沉积的程度上。针对晚期疾病,IFNε的治疗被推迟四周,使得原位肿瘤有时间确立,但这并不降低IFNε的整体疗效,它仍然强烈抑制了卵巢癌在腹腔中的扩散。
尽管IFNε对转移肿瘤有明显影响,但它对原发肿瘤的大小减小的影响趋势并不明显。研究者观察到,外源性IFNε治疗诱导了干扰素刺激基因IRF9的表达,并且似乎增加了CD3+T细胞的数量。这与女性HGSOC的肿瘤特点相符,这些肿瘤被认为在很大程度上缺乏免疫原性。此外,IFNε对腹腔转移的影响显著大于对原发肿瘤的影响,这与临床上的情况相关,因为转移进展是决定HGSOC女性预后的主要因素。
最后,研究者在一个模拟晚期卵巢癌的模型中证实了IFNε对高负荷肿瘤的抑制效果,减少了腹腔内肿瘤的生长和恶性出血性腹水的发展。与另一种I型干扰素IFNβ相比,IFNε在所有模型中表现更为有效。这一研究强调了IFNε在FRT上皮中独特的抗肿瘤特性,以及其在抑制HGSOC肿瘤生成和转移中的潜在作用。
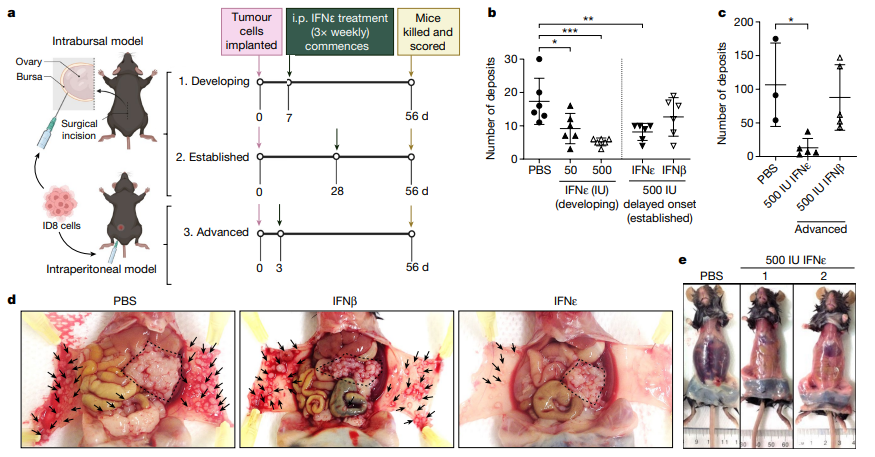
图2 IFNε抑制发展中、已建立和晚期伴有腹膜转移的卵巢癌模型
【IFNε的机制】
传统的I型干扰素通常通过直接影响肿瘤细胞或间接调控免疫细胞来抑制肿瘤生长,但IFNε的这些作用尚未被深入研究。研究通过广泛的免疫表型分析发现,在携带肿瘤的小鼠中,腹腔内免疫细胞数量增加,包括CD8+和CD4+ T淋巴细胞、自然杀伤细胞、单核细胞、中性粒细胞和髓源性抑制细胞(MDSCs)。IFNε在已确立的肿瘤模型中减少了免疫细胞数量,但在发展中或先进的模型中只显示出较小的趋势。然而,接受IFNε治疗的小鼠中的免疫细胞被显著激活,表现为CD4+和CD8+ T细胞以及自然杀伤细胞上CD69表达的增加。此外,腹腔内的CD4+ T细胞也显示出免疫检查点分子PD-1的增加。
研究还展示了IFNε对腹腔内细胞毒性淋巴细胞的功能激活。通过对接受IFNε或PBS治疗的小鼠的腹腔渗出细胞(PECs)进行实验,研究发现接受IFNε治疗的小鼠的腹腔细胞对ID8细胞的溶解能力增加,细胞毒性CD8+ T细胞和自然杀伤细胞上的CD107a表达也增加。因此,IFNε不仅在肿瘤模型中调节了激活的抗肿瘤免疫细胞的比例,还在功能上激活它们来杀死肿瘤细胞。
此外,研究还揭示了IFNε对肿瘤细胞的直接抑制作用。IFNε对ID8肿瘤细胞诱导了剂量依赖的凋亡,减少了活细胞的比例,并表现出抗增殖效应。这些效应涉及与细胞周期、增殖、存活和凋亡等相关的基因表达的改变。IFNε在体外分子和功能抗肿瘤试验中的效应更强大,与其他I型干扰素相比,尤其是IFNβ。
研究还使用Ifnar1−/−小鼠探究了IFNε的直接和间接抗肿瘤作用。结果显示,尽管在缺乏Ifnar1的小鼠中,IFNε不能直接影响免疫细胞,但它仍然通过直接作用于肿瘤细胞抑制了肿瘤的发展。然而,IFNε的间接效应,如抗肿瘤免疫应答,也在抗肿瘤效应中发挥了重要作用。
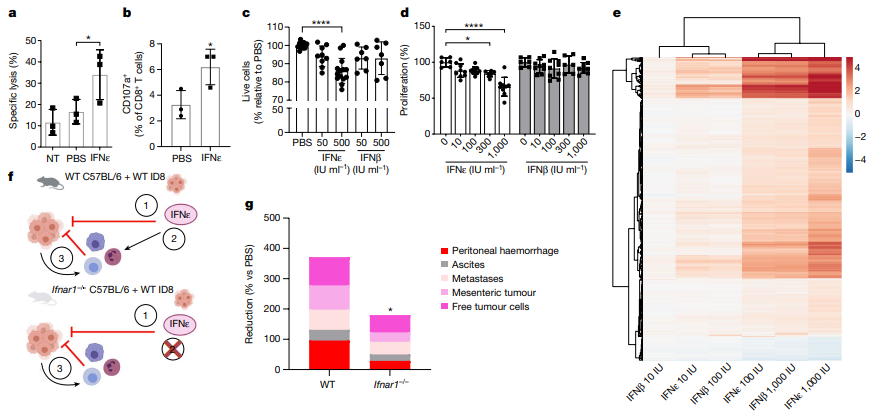
图3 IFNε的抗肿瘤活性机制。
【IFNε作为HGSOC潜在治疗方法】
研究发现,IFNε对肿瘤有多种作用方式。在体内,IFNε通过直接影响肿瘤细胞或间接作用于免疫细胞来抑制肿瘤生长。在PDX模型中,人类IFNε对敏感型HGSOC PDX111的肿瘤抑制效果显著,通过诱导和抑制基因表达来表现。然而,在对抗性的PDX183模型中,IFNε则无法调节基因表达,导致对肿瘤的抑制效果不显著。实验还表明,IFNε在直接抑制肿瘤细胞的同时,还能间接激活抗肿瘤免疫反应,通过激活CD8+和CD4+ T细胞、自然杀伤细胞等,从而提高它们对肿瘤细胞的杀伤能力。此外,IFNε还被发现在体外对肿瘤细胞具有直接抑制作用,诱导细胞凋亡和抑制增殖。
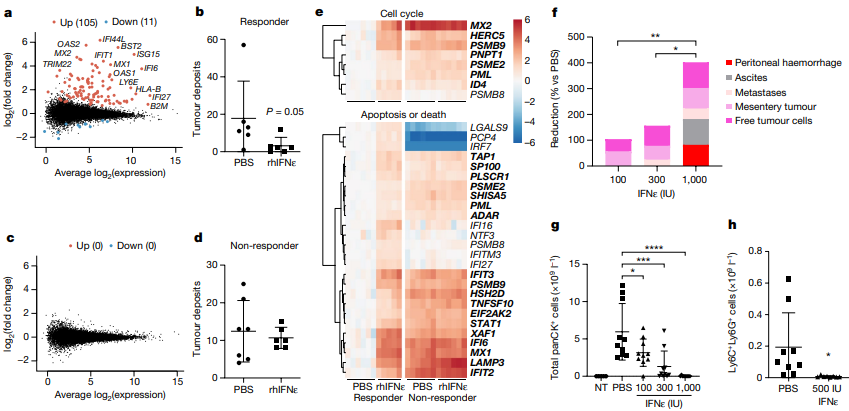
图4 IFNε对HGSOC的PDX模型和晚期卵巢癌的ID8TB模型的影响
通过使用PDX模型和CRISPR技术改造的肿瘤细胞线,研究表明IFNε在抗肿瘤免疫中发挥着关键作用。实验证据表明,IFNε通过直接作用于肿瘤细胞和间接调节免疫细胞来抑制肿瘤生长。在PDX模型中,IFNε能够诱导敏感型HGSOC肿瘤的基因调控,从而抑制肿瘤生长。实验结果还显示,在特定PDX模型中,IFNε通过激活抗肿瘤免疫细胞并促使它们杀死肿瘤细胞来产生功能性效应。此外,通过对基因表达和细胞增殖的调节,IFNε还直接影响肿瘤细胞的凋亡和增殖。当IFNε作用于肿瘤细胞时,其调节的基因与IFNβ相同,但作用更为强大。通过进一步研究IFNε对不同类型的肿瘤模型,包括缺乏IFNAR1的模型,以及免疫细胞活性和免疫环境的调节,揭示了IFNε在调节肿瘤生长和免疫应答中的关键作用。
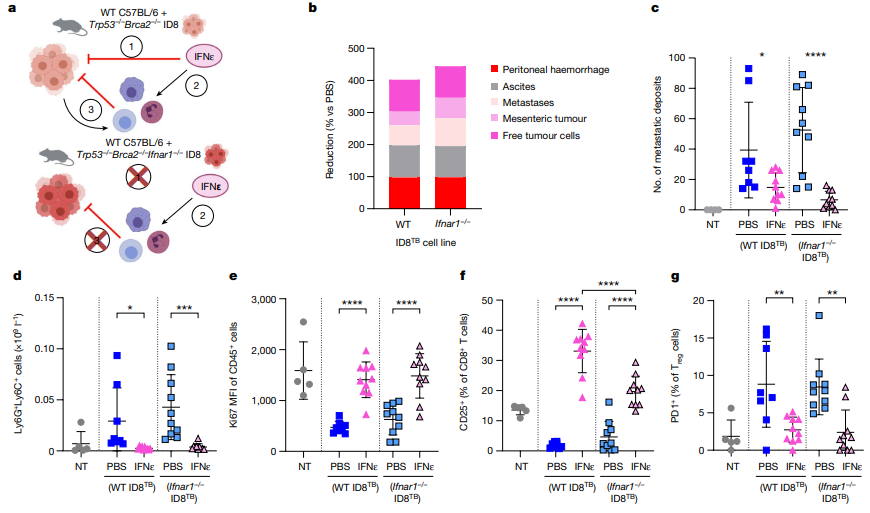
图5 IFNε在晚期卵巢癌的ID8TB模型中对IFN响应性和非响应性肿瘤细胞同样有效
【小结展望】
总之,该论文展示了IFNε具有保守的、跨物种的抗肿瘤性质,结合其在输卵管上皮中的常规表达,HGSOC的发生地,以及在卵巢肿瘤发生中其表达的丧失,支持IFNε作为独特的肿瘤抑制因子。作者证明了内源性和外源性IFNε在HGSOC的发展和治疗中的潜力,特别是腹腔内免疫微环境在控制HGSOC转移中的重要性。由于高级别浆液性卵巢癌的晚期诊断、强大的转移能力和对化疗的耐药性,这项研究的成果为该疾病的治疗提供了新的方向。IFNε的抗肿瘤活性和免疫调节作用使其成为潜在的治疗候选药物,可望改善卵巢癌患者的生存率。
原文链接:
https://www.nature.com/articles/s41586-023-06421-w
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










签到学习
0