Sci Signal:我们找到了帕金森病和阿兹海默病的共同元凶
2017-07-22 佚名 药明康德
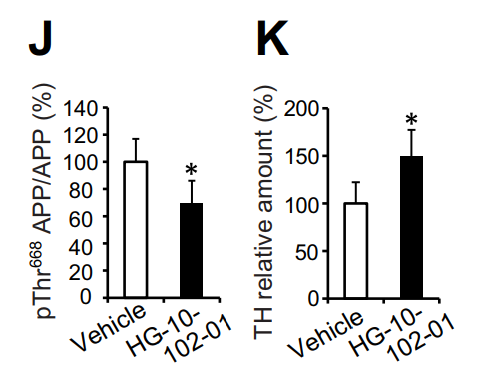
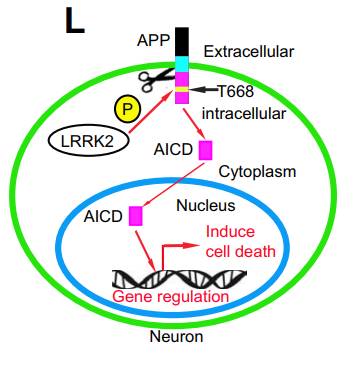
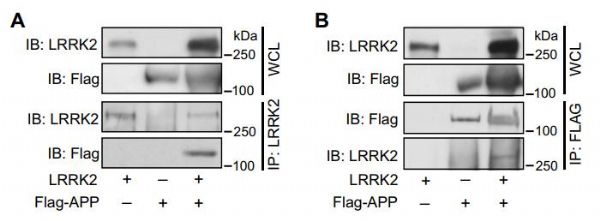
阿兹海默病和帕金森病是两种最为常见的神经退行性疾病,不过,两者的病理特征、影响的大脑部位和临床症状有很大的区别。在阿兹海默病患者脑内,由β淀粉样蛋白形成的斑块和tau蛋白形成的神经缠结导致了位于海马体和前额叶皮层的神经细胞死亡,使患者的认知和记忆功能衰退。而在帕金森病患者中,由α-synuclein蛋白形成的路易氏体主要影响中脑的黑质部分,导致患者的运动功能受损。

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Sign#
33
#Signal#
39
#阿兹海默病#
38
神经毒性,学习了~
79
文章不错,谢谢分享
73