Circulation:高盐伤肝,二甲双胍或可破!科学家发现,高盐饮食能够诱导肝脏炎症记忆,导致心血管损伤
2022-03-28 奇点网 奇点网
这些发现可能会为高盐诱导的心肝损伤提供新的治疗策略,具有深远的临床应用意义。
口味重的吃货们注意啦,这是一篇与我们日常生活关系密切的科普。
大家都知道,高盐饮食是心血管疾病的主要饮食风险因素。同时,还有证据表明高盐饮食与非酒精性脂肪性肝病相关[1],而非酒精性脂肪性肝病也是心血管疾病的独立危险因素[2]。
那么,高盐导致的肝损伤是否会影响心血管疾病的发生发展呢?
近日,由国内陆军军医大学大坪医院高血压和代谢疾病中心祝之明医生领衔的研究团队,在心血管领域顶级期刊《循环》发表重要研究成果[3]。
他们发现,高盐饮食会增加肝细胞中去乙酰化酶SIRT3的表观遗传学修饰,抑制了其与NRF2的结合,导致SIRT3的表达被持续抑制,从而介导了肝脏脂肪变性和肝脏盐性炎症记忆及心血管损伤,通过AMPK激活剂二甲双胍可以提高SIRT3表达,逆转肝脏炎症记忆,改善心血管损伤。
由此可见,避免过多的盐摄入和积极干预表观遗传修饰可能有助于避免高盐诱发的心血管损伤的持续性炎症状态,二甲双胍有望成为治疗高盐摄入诱导的肝脏疾病的潜在药物。

论文首页截图
在肝脏代谢中有一个概念被人们逐渐熟知,那就是“代谢记忆”——高糖、高脂肪和高盐介导的血管紧张素II改变等各种饮食和代谢因素,会引起靶器官损伤,并且恢复了正常饮食和正常代谢水平后,损伤仍然存在[4]。
目前已知在糖尿病肾病中,炎症、氧化应激和表观遗传修饰是其发病的主要原因。其中,增加活性氧的生成,可调节促炎基因启动子的组蛋白表观遗传修饰,进而导致低度慢性炎症状态,这一机制在糖尿病并发症中发挥了重要作用[5]。
值得注意的是,线粒体作为活性氧的主要来源,线粒体功能障碍不仅会降低氧化呼吸链的活性,导致肝脏脂肪沉积,还会触发先天免疫反应,从而促进非酒精性脂肪性肝病(NAFLD)的发生[6]。
通过查阅文献,研究人员们发现SIRT3(sirtuin 3)是抑制线粒体中活性氧生成的去乙酰化酶,在小鼠中敲除SIRT3可以通过诱导线粒体蛋白的乙酰化,进而导致脂肪肝和代谢综合征[7]。然而,SIRT3是否参与高盐诱导的肝脏炎症记忆仍有待进一步研究。
据研究报道,肝脏脂肪变性与C-反应蛋白水平升高之间存在关联,而C-反应蛋白是心血管不良预后的关键预测因子。并且,NAFLD还能通过引发全身性炎症、诱导胰岛素抵抗、增加氧化应激等方式,促进高血压的发生,这与高盐在其中的作用十分相似,但是,高盐诱导的NAFLD是否是心血管疾病发生发展的重要因素还不清楚。

图片来自veer.com
于是研究人员们试图探究高盐饮食引起的肝脏脂肪变性是否是心血管损伤的主要原因呢?以及SIRT3是否参与其中,潜在的机制又是什么呢?
接下来,我们一起看看他们是如何开展研究的。
首先研究人员们发现,高盐饮食(HSD)会使小鼠的收缩压显著升高,心功能明显受损,射血分数和短轴缩短率降低。此外,HSD还显著增加了血清中促炎标志物的水平。喂食HSD的小鼠也表现出更高的肝脏重量/体重比。恢复正常饮食后全身炎症和肝损伤,以及高血压均未恢复到正常水平,表明还持续存在着肝损伤和血管损伤。
HSD还刺激了肝脏中的脂质积累、脂肪变性和纤维化,甘油三酯、总胆固醇和非酯化脂肪酸水平、中性粒细胞和巨噬细胞浸润显著增加,恢复正常饮食后仍然未能缓解这些肝脏和炎症的病理变化。这些结果表明,高盐引起的肝损伤表现出“记忆”特征。
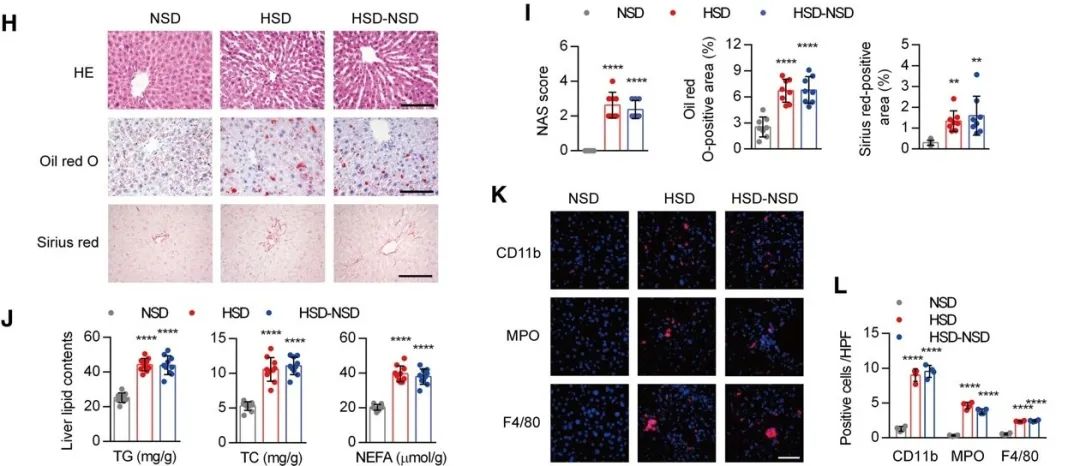
高盐饮食后小鼠肝脏和炎症的变化
他们通过检测也发现,HSD显著抑制肝脏中SIRT3的表达,即使在停盐后也是如此。
为了研究SIRT3在记忆现象中的重要性,HSD小鼠在恢复正常饮食之前被注射了 AAV8-TBG-SIRT3(一种用来过表达SIRT3的病毒)。
注射AAV8-TBG-SIRT3小鼠的天冬氨酸氨基转移酶和促炎细胞因子水平显著降低。此外,SIRT3过表达显著减弱了停盐后的肝细胞脂肪变性、脂质积累和纤维化,以及炎症细胞浸润,也抑制了促炎基因的表达。因此,肝脏中的记忆现象可能与SIRT3持续的低表达有关。
出乎意料的是,AAV介导的肝脏中SIRT3过表达不仅显著降低了盐诱导的高血压,而且停盐后的心功能障碍也得到了恢复,提示肝脏中SIRT3的低表达也是高盐诱导的心血管损伤的关键一环。
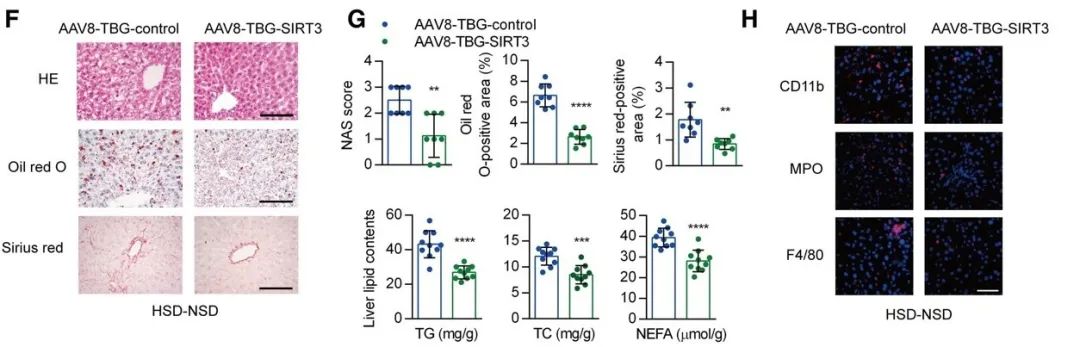
AAV8-TBG-SIRT3过表达小鼠肝脏和炎症的变化
接下来,研究人员们使用SIRT3敲除(SIRT3-/-)小鼠来模拟SIRT3表达降低的状态。
在SIRT3-/-小鼠中,HSD诱导的肝损伤、组织形态学变化和炎症细胞浸润现象更加严重。此外,敲除SIRT3可以增加促炎因子的表达,这进一步促进了HSD对这些促炎因子的作用。敲除SIRT3也会加重高盐诱导的高血压和心功能不全。
为了进一步确定SIRT3在肝脏中的作用,他们构建了肝脏特异性SIRT3敲除小鼠,并给它们喂高盐饮食。正如预期的那样,与同窝SIRT3正常表达小鼠相比,肝脏敲除SIRT3后小鼠的肝脂肪变性和肝脏纤维化更加明显,且伴有更严重的高血压和心功能不全。
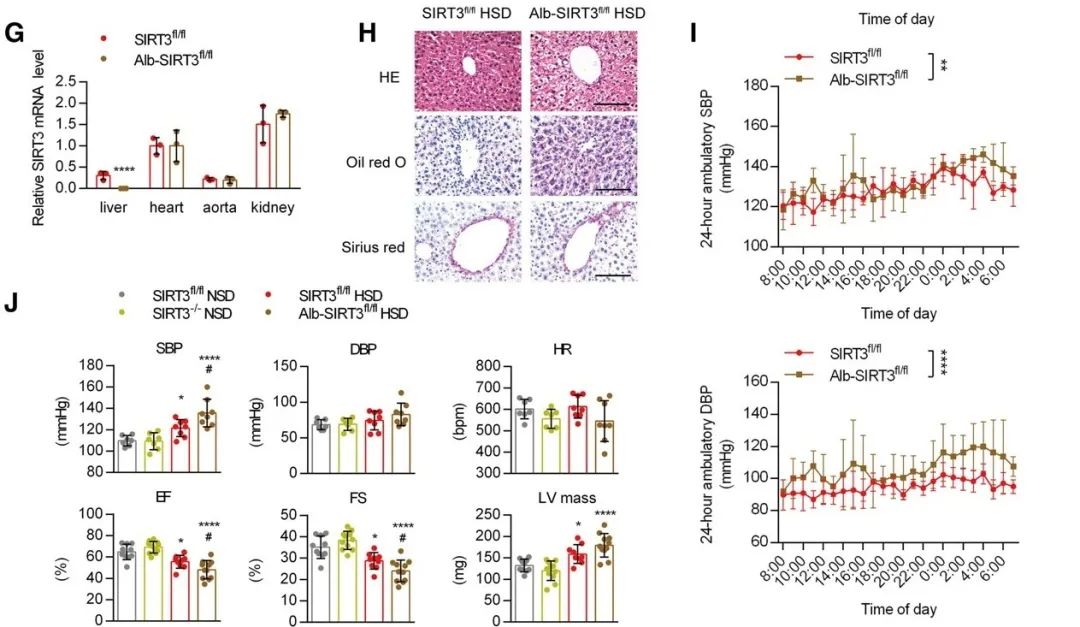
肝脏特异性SIRT3敲除小鼠肝脏和炎症的变化
随后研究人员们注意到,组蛋白3赖氨酸27(H3K27)的乙酰转移酶p300在肝脏中的表达增加。他们敲低或抑制p300发现都可以消除H3K27的高乙酰化,并且降低停盐后促炎因子的表达。同时,原本表达下降的SIRT3也恢复到了正常水平。
然而,为什么 H3K27乙酰化(H3K27ac)对SIRT3表达的影响与促炎因子相反呢?他们再次分析了SIRT3基因的启动子区域,发现了NRF2的结合位点,NRF2是SIRT3的正调节因子,在IL-6和CCL2的启动子中均不存在。并且,HSD显著抑制了NRF2与SIRT3启动子区域的结合,在恢复到正常饮食后这种抑制作用持续存在。
这些结果表明,H3K27ac抑制NRF2结合是停盐后SIRT3表达持续下降的主要原因。
此外,他们还通过实验阐述,抑制NRF2与SIRT3启动子的结合对高盐诱导的组蛋白表观遗传修饰是至关重要的,以及NRF2对肝脏的保护作用也需要SIRT3的存在。
接下来,他们试图搞清楚哪种干预措施可以防止盐性炎症记忆。
根据ChIP测序结果显示,SIRT3基因敲除主要影响AMPK和胰岛素信号通路相关基因。众所周知,二甲双胍是AMPK激活剂,它可以改善由高葡萄糖或高脂饮食引起的持续性靶器官损伤。他们建立了两种给药模型:一种是在高盐饮食中添加二甲双胍后喂养小鼠16周(HSD+Met);另一种是在前8周给予含二甲双胍的HSD,后8周停盐但持续给予二甲双胍(HSD-Met)。两种给药方法都降低了小鼠的肝脏重量与体重比,血清中AST/ALT比值和促炎因子的表达。
二甲双胍不仅减轻了HSD引起的肝损伤和炎症,而且完全阻断了盐性炎症记忆现象,改善了HSD引起的高血压和心功能不全。这些结果表明二甲双胍对高盐诱导的肝脏炎症记忆具有有效的治疗作用。
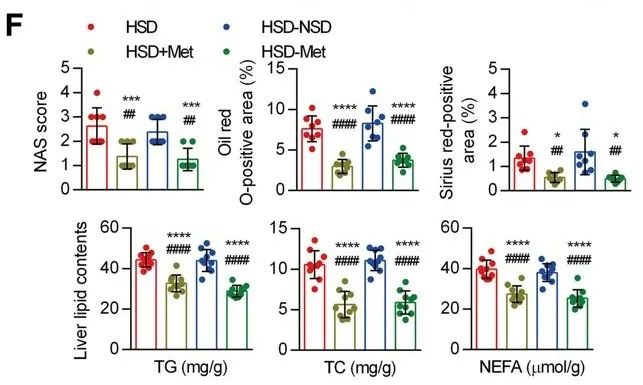
二甲双胍减轻HSD引起的肝损伤
最后他们发现小鼠敲除AMPKα2(在肝脏中表达的主要形式)后不仅阻断了二甲双胍对HSD诱导的肝脂肪变性的预防作用,而且消除了停盐后二甲双胍改善这些病理表征的治疗作用。由此可见,AMPK是二甲双胍预防和治疗高盐诱导的肝脏炎症和肝脂肪变性中所必需的,以及SIRT3的激活也依赖于AMPK。
综上,肝脏中低表达的SIRT3是高盐诱导的肝脏炎症和肝脂肪变性的重要因素。高盐饮食通过表观遗传修饰来抑制SIRT3的转录,从而导致肝脏炎症持续存在。在肝脏中过表达SIRT3,或使用二甲双胍激活SIRT3,可有效缓解小鼠持续性肝损伤,从而改善高盐诱导的心血管损伤。
这个研究揭示了肝脏脂肪变性和炎症在高盐诱导的心血管损伤中发挥重要作用,服用改善肝脏代谢的药物,如二甲双胍,可能有助于减轻高盐引起的心血管损伤。并且AMPK/SIRT3通路可能是治疗高盐饮食人群中持续性心肝损伤的一个有潜力的干预靶点。
这些发现可能会为高盐诱导的心肝损伤提供新的治疗策略,具有深远的临床应用意义。
参考文献
[1] Xu J, Mao F. Role of high-salt diet in non-alcoholic fatty liver disease: a mini-review of the evidence [published online ahead of print, 2021 Nov 12]. Eur J Clin Nutr. 2021;10.1038/s41430-021-01044-8. doi:10.1038/s41430-021-01044-8
[2] Han E, Lee YH, Kim YD, et al. Nonalcoholic Fatty Liver Disease and Sarcopenia Are Independently Associated With Cardiovascular Risk. Am J Gastroenterol. 2020;115(4):584-595. doi:10.14309/ajg.0000000000000572
[3] Gao P, You M, Li L, et al. Salt-Induced Hepatic Inflammatory Memory Contributes to Cardiovascular Damage Through Epigenetic Modulation of SIRT3. Circulation. 2022;145(5):375-391. doi:10.1161/CIRCULATIONAHA.121.055600
[4] Kumar S, Pamulapati H, Tikoo K. Fatty acid induced metabolic memory involves alterations in renal histone H3K36me2 and H3K27me3. Mol Cell Endocrinol. 2016;422:233-242. doi:10.1016/j.mce.2015.12.019
[5] Tonna S, El-Osta A, Cooper ME, Tikellis C. Metabolic memory and diabetic nephropathy: potential role for epigenetic mechanisms. Nat Rev Nephrol. 2010;6(6):332-341. doi:10.1038/nrneph.2010.55
[6] Begriche K, Massart J, Robin MA, Bonnet F, Fromenty B. Mitochondrial adaptations and dysfunctions in nonalcoholic fatty liver disease. Hepatology. 2013;58(4):1497-1507. doi:10.1002/hep.26226
[7] Weir HJ, Lane JD, Balthasar N. SIRT3: A Central Regulator of Mitochondrial Adaptation in Health and Disease. Genes Cancer. 2013;4(3-4):118-124. doi:10.1177/1947601913476949
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#高盐#
45
#血管损伤#
60
#科学家发现#
52
#损伤#
53
#肝脏炎症#
45