北京协和医学院AFM:双特异性类外泌体脂质纳米颗粒递送双siRNA用于胰腺癌的协同治疗
2024-03-12 BioMed科技 BioMed科技
研究员报道了可携带高载荷量siKras和siTP53的双特异性类外泌体脂质纳米颗粒(EM-LNPs),它可以有效地克服屏障以实现细胞质富集,并实现PDAC肿瘤的协同治疗。
虽然RNA疗法在对抗胰腺导管腺癌(PDAC)方面具有一定的前景,但由于载体的递送效率不足以及单个siRNA的先天治疗效力不足,对此类癌症的治疗效果十分有限,也阻碍了此类疗法更广泛的应用。
在本研究中,中国医学科学院北京协和医学院Xinming Zhao等人报道了可携带高载荷量siKras和siTP53的双特异性类外泌体脂质纳米颗粒(EM-LNPs),它可以有效地克服屏障以实现细胞质富集,并实现PDAC肿瘤的协同治疗。EM-LNPs继承了-LNPs的特征以及具有外部CD47蛋白,膜插入整合素α6β4和连接蛋白43的外泌体的蛋白质特征。载有siRNA的EM-LNPs可以有效地逃避循环中的宿主免疫清除,大量积累和穿透致密肿瘤,并在渗入细胞质后同时靶向PDAC细胞的EGFR/VEGF。细胞内富集的siKras和siTP53对PDAC细胞具有协同治疗作用,可抑制异种移植PDAC肿瘤,显著减少肺转移,并在低注射剂量下大大延长小鼠存活时间。这些结果探索了一种将多基因递送至致密PDAC肿瘤以进行协同治疗的方法。相关工作以“Bispecific, Exosome-Mimetic Lipid Nanoparticles Facilitate Dual siRNAs for Synergistic Therapy against Pancreatic Cancer”为题发表在Advanced Functional Materials。

【文章要点】
针对多个PDAC突变的新RNAi疗法的需求目前尚未得到满足。研究显示,95%的PDAC肿瘤中存在KRAS的热点突变,KRAS是驱动PDAC起始、进展和转移的小GTP酶RAS超家族的成员。此外,突变TP53也在PDAC中非常常见,其可以使肿瘤抑制功能失活。有趣的是,突变型TP53已被发现与近70%的PDAC中的Kras突变共同发生,这可以相互作用并调节Kras活性,例如通过靶向突变型p53的剪接轴来减少Kras信号传导。因此,通过siRNA同时沉默突变型Kras和突变型TP53有望对PDAC取得更突出的治疗效果。为此,在本项研究中,作者提出了EM-LNP以同时高效包封siKrasG12D(siKras)和siTP53这两种siRNA。EM-LNP是通过将双靶向的典型可电离LNP与蛋白质(整联蛋白α6β4和连接蛋白43)插入的融合LNP整合而构建的,作者还进一步用CD47蛋白和双特异性蛋白Bi-50对该LNP进行功能化(图1)。
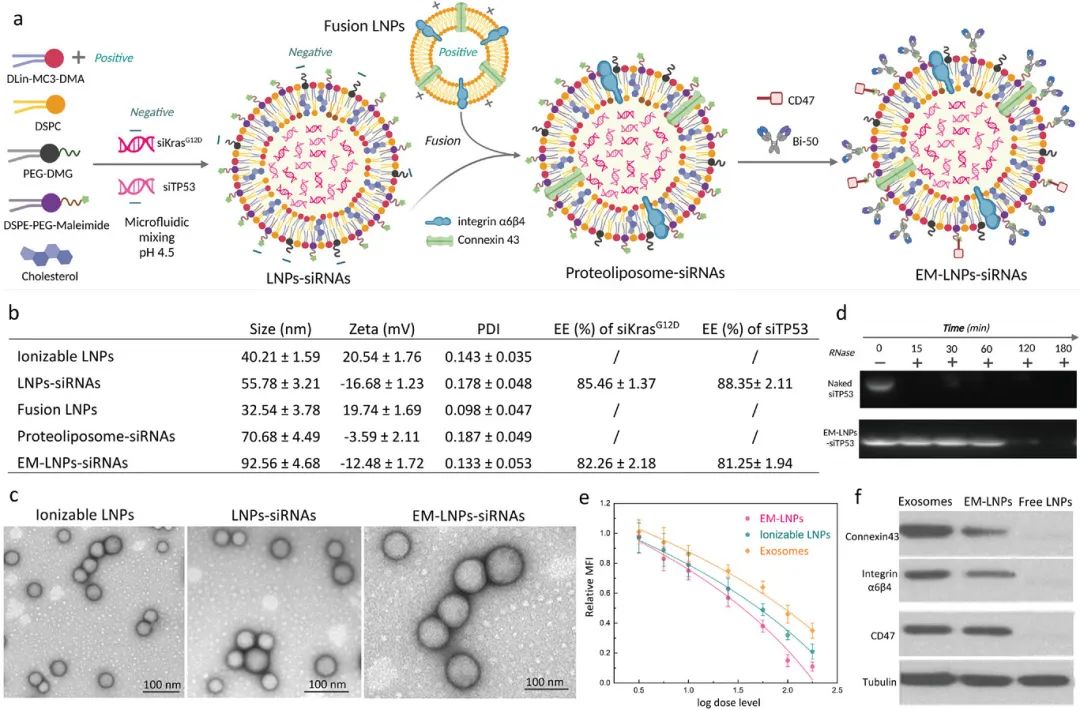
图1 负载siRNA的EM-LNPs
表面缀合的Bi-50可以以高特异性同时靶向PDAC细胞的EGFR/VEGF,然后在整合素和连接蛋白的帮助下将siRNA泄漏到细胞质中,从而逃避内体过程(图2)。细胞内siKras和siTP53在体外和体内对AsPC-1和PANC-1细胞具有协同治疗作用,其体外疗效增强高达20倍,体内疗效增加了3.5倍。此外,它们抑制了快速发展的PANC-1 PDAC肿瘤,减少了肺转移,并延长了动物的存活时间。该工作为多siRNA提供了一种高效的递送技术,并证明了siKras和siTP53的协同增强治疗效果,为难治性癌症提供了新的治疗策略。
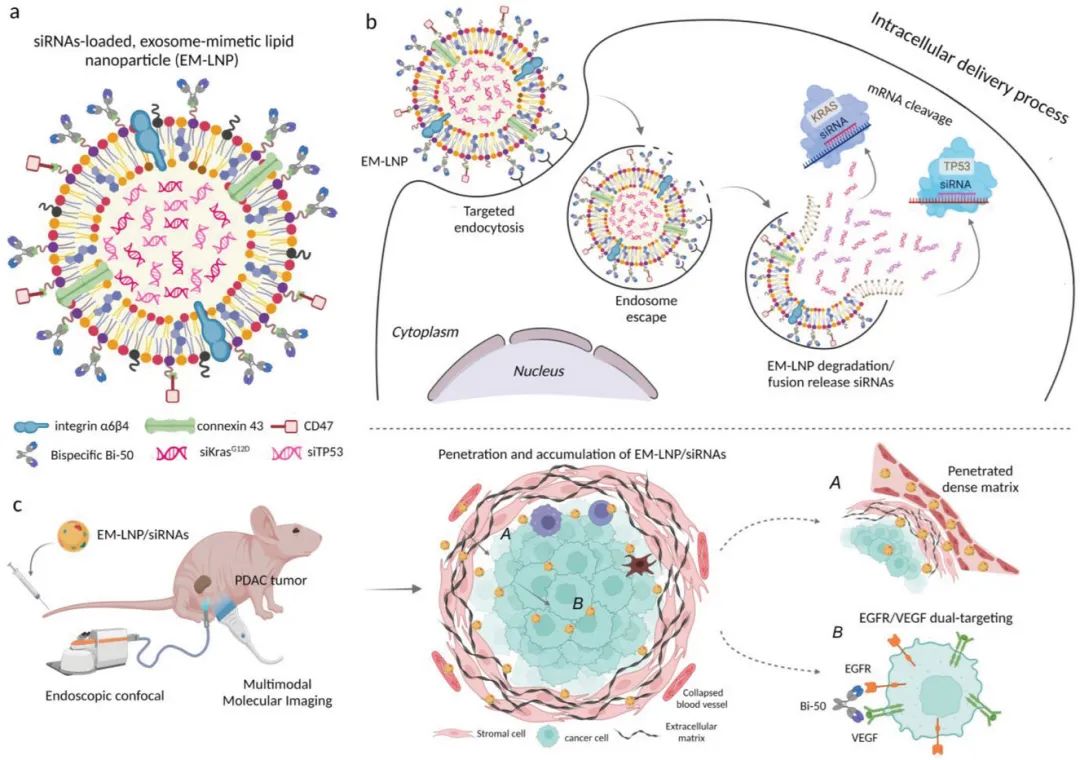
图2 协同抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202400485
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#胰腺癌# #双特异性类外泌体脂质纳米颗粒# #双siRNA#
73