吉林大学刘镇宁教授/王冰迪博士团队《Adv. Sci.》:原位注射亚精胺功能化水凝胶抗炎和促进急性/糖尿病伤口愈合
2024-04-18 BioMed科技 BioMed科技
该文章利用“师法自然”的仿生思想局部施用亚精胺,为减轻外源性生物材料引起的异物反应开发了一种简单而优雅地解决策略,并为治疗慢性难愈合创面提供了新思路。
近日,吉林大学工程仿生教育部重点实验室的刘镇宁教授/王冰迪博士团队,在 Advanced Science 期刊上发表了题为:“Spermidine-Functionalized Injectable Hydrogel Reduces Inflammation and Enhances Healing of Acute and Diabetic Wounds In Situ”的文章。该团队受生物活性小分子亚精胺免疫调节功能的启发,利用动态席夫碱反应和原位光引发聚合双重交联策略,开发了一种亚精胺功能化的双网络可注射水凝胶(DN-SPD)。体外理化实验表明,DN-SPD水凝胶表现出良好的力学性能和组织黏附性,光交联前的单网络水凝胶(SN-SPD)具有优异的可注射性,可通过原位打印和光交联形成双网络水凝胶。体外生物学实验和3组动物体内实验结果表明,DN-SPD水凝胶具有良好的生物相容性、抗氧化性、低免疫原性和优异的免疫调控作用,能够减轻由外源性植入物和活性氧引起的炎症反应,调控巨噬细胞向抗炎、促再生的M2表型极化,从而实现更快和更自然的急性伤口和糖尿病伤口愈合,使皮肤恢复到更接近自然皮肤的状态。该文章利用“师法自然”的仿生思想局部施用亚精胺,为减轻外源性生物材料引起的异物反应开发了一种简单而优雅地解决策略,并为治疗慢性难愈合创面提供了新思路。这一策略可能在组织再生和器官移植方面具有重要意义。刘镇宁教授和王冰迪博士为该文章通讯作者,博士生吴倩倩为第一作者。

研究背景
生物材料在组织工程和植入医疗器械中发挥着越来越重要的作用。然而,外源生物材料可能触发宿主免疫系统对外来植入材料的免疫排异反应(foreign body reaction, FBR),导致严重炎症。炎症被认为是影响组织再生的一个关键因素。因此,地塞米松和肝素等抗炎药物被用于赋予生物材料免疫调节功能。然而,这些药物的使用往往导致不良反应和高昂的成本。
在哺乳动物的受精过程中,雄性精子需要进入雌性子宫以完成受精。但精子对于雌性是一种外来物,雌性的免疫系统将被激活,消灭这些“入侵者”。亚精胺(SPD)是一种最初在精液中发现的天然多胺。有报道称,不育男性精液中的亚精胺水平明显较低,因此,有人推测亚精胺可以调节女性免疫系统,保护“入侵者”精子,以利于受精。与之相一致的是,动物实验表明,亚精胺可以提高受精卵移植和发育的成功率。此外,还有一些研究已经证明亚精胺具有更广泛的免疫调节功能,例如抗炎作用和提高抗肿瘤免疫。
因此,该研究团队设计了一种基于亚胺键动态共价交联和光引发非动态共价交联的亚精胺功能化双网络水凝胶,实现了良好的生物可打印性、机械强度和理想的降解率。亚精胺功能化双网络水凝胶的局部施用可减弱外源性植入材料引起的免疫排异反应,促进急性和糖尿病创面的愈合。
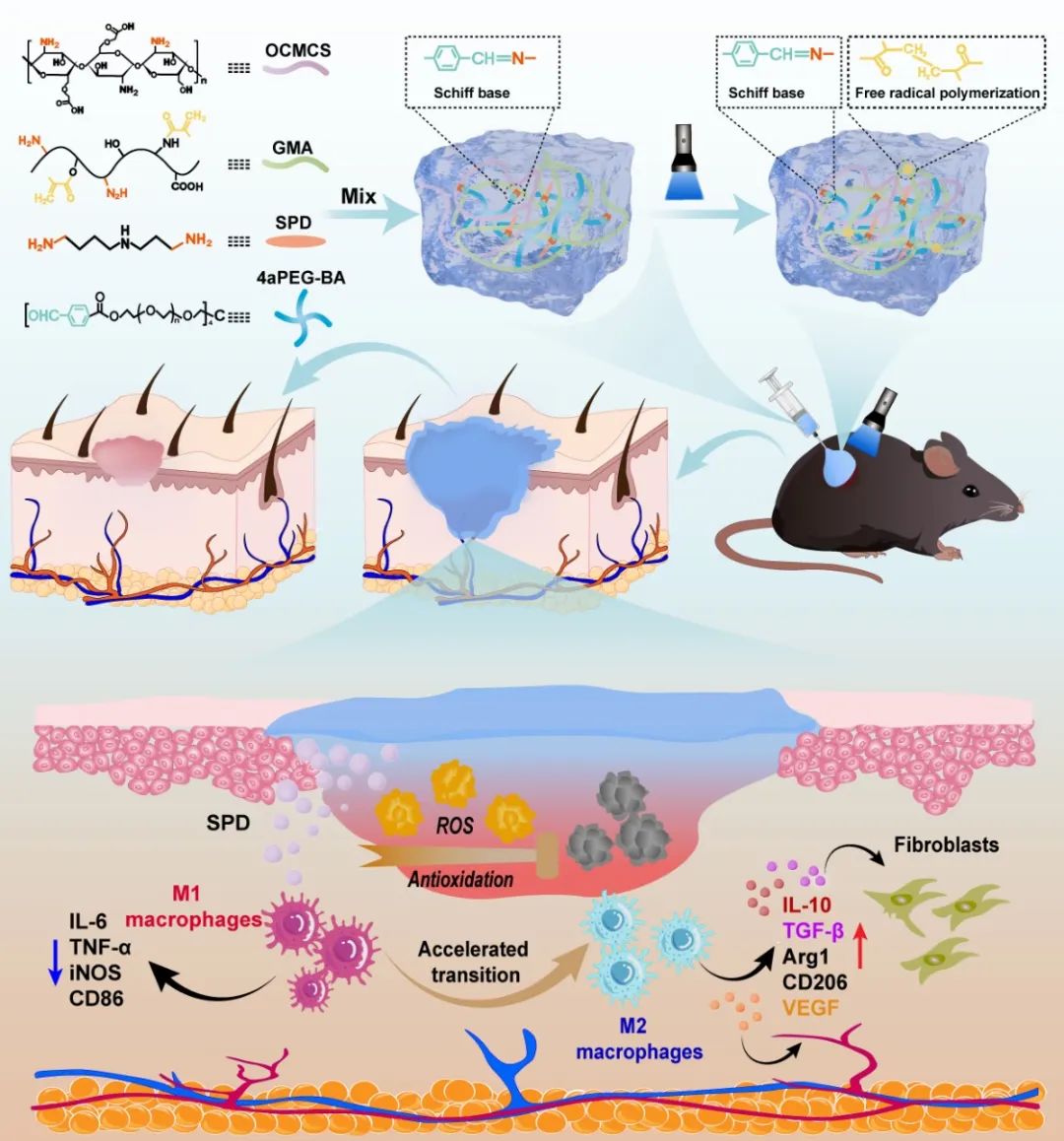
图1. 文章概要图
文章要点
要点一:该团队将O-羧甲基壳聚糖(OCMCS)和甲基丙烯酰化明胶(GMA)作为基质生物材料,天然小分子亚精胺(SPD)作为生物活性成分,苯甲醛封端的4臂聚乙二醇(4aPEG-BA)作为交联剂,室温下将含有不同浓度SPD的OCMCS/GMA/SPD溶液与4aPEG-BA交联剂溶液混合,该体系内的SPD的氨基、OCMCS分子链上的氨基和GMA分子链上的部分氨基与4aPEG-BA交联剂的醛基发生席夫碱反应,形成动态亚胺键,构建了单网络水凝胶(SN)。然后,SN水凝胶在蓝光(405 nm)照射下,引发体系内GMA发生自由基聚合,形成第二个非动态共价交联网络。体外理化实验表明,亚精胺功能化双网络水凝胶具有典型的微观多孔结构、理想的溶胀性能、优异的可注射性和力学性能以及原位组织粘附性。更重要的是,两步交联策略实现了水凝胶可注射性和机械性能的平衡。
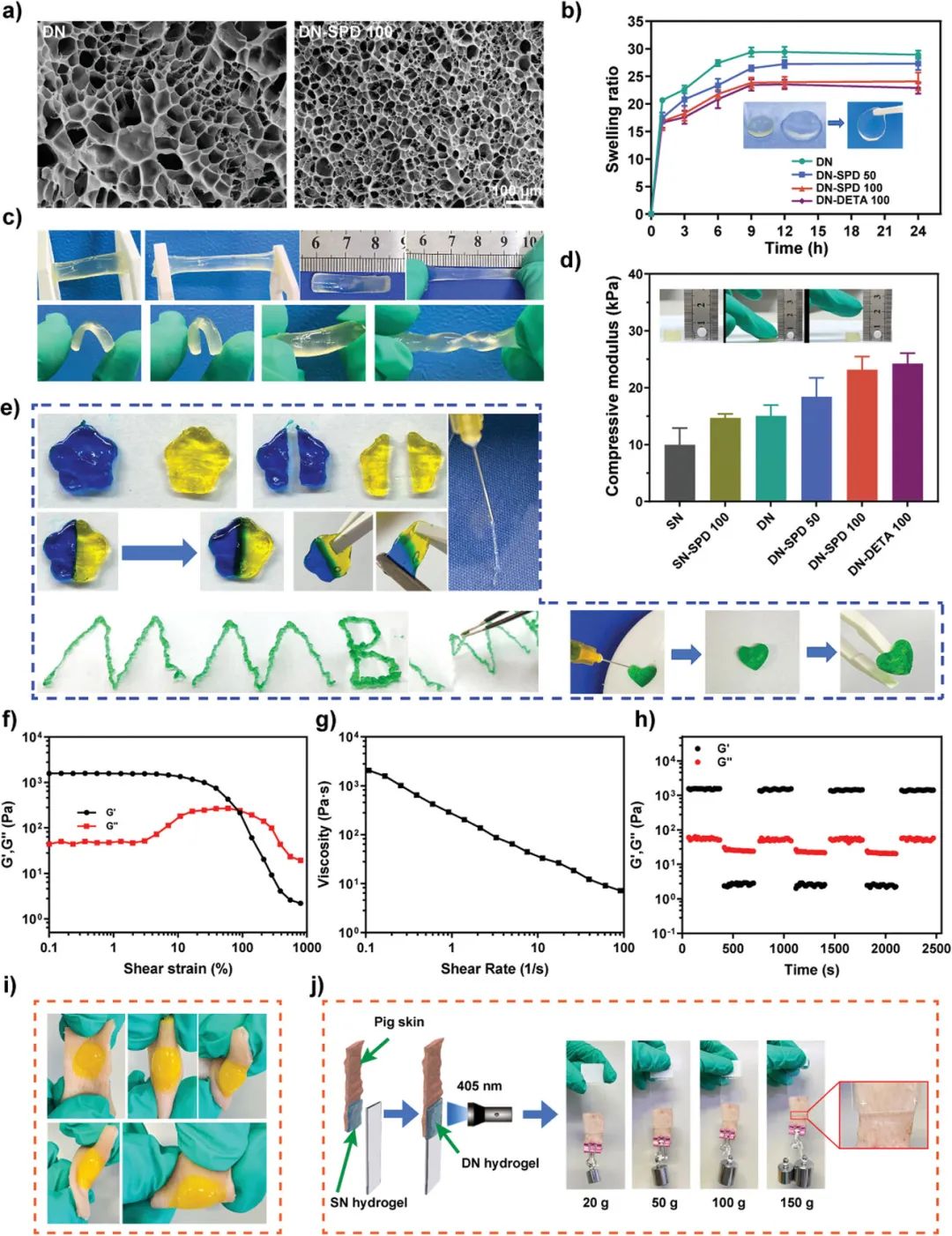
图2. 亚精胺功能化可注射双网络水凝胶(DN-SPD)的理化性能
要点二:外源性聚合物材料作为植入材料时,均会被宿主视为“异物”,引发免疫排斥,导致严重的炎症反应。为了确认亚精胺在外源性生物材料植入场景下的抗排异炎症调节功能,该团队选择与SPD化学结构相似的二乙烯三胺(DETA)作为对照,制备了负载DETA的对照组可注射水凝胶。具体来说,DETA是一种对称分子,仲胺两侧各有两个2-氨基乙基。与DETA相比,SPD在仲胺的一侧多了两个亚甲基,另一侧多了一个亚甲基,这使得SPD成为具有多种作用的不对称分子。因此,负载SPD的水凝胶(DN-SPD)与负载DETA的水凝胶(DN-DETA)具有相似的理化特性,但二者的免疫调节功能却大相径庭。与DN-DETA水凝胶相比,DN-SPD水凝胶能够显著降低细胞产生的ROS、调控RAW 264.7巨噬细胞表型极化、促进巨噬细胞由促炎M1型向抗炎M2型极化,并可以降低由脂多糖(LPS)刺激导致的促炎因子白介素6(IL-6)和肿瘤坏死因子(TNF-)的分泌,同时促进抗炎因子白介素10(IL-10)的产生。负载DETA的水凝胶则不具有上述作用。
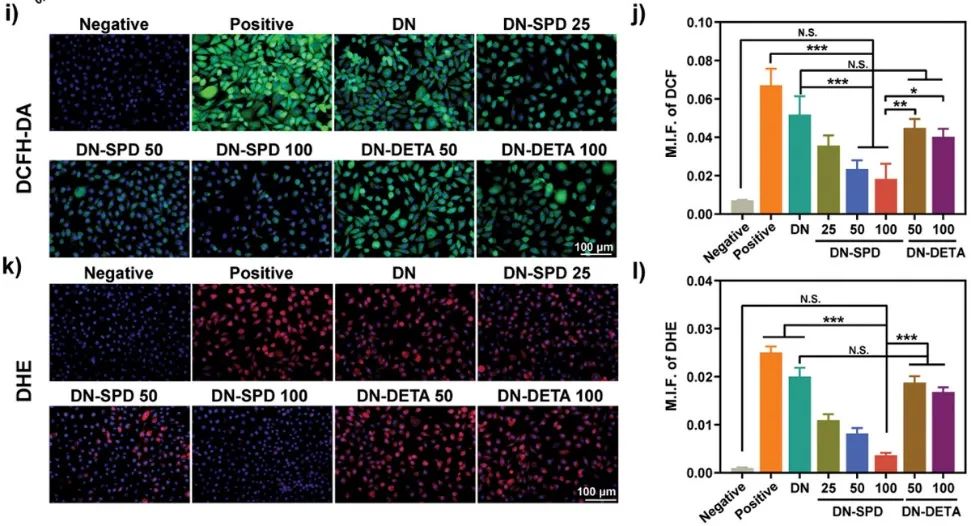
图3. 亚精胺功能化可注射双网络水凝胶对细胞内活性氧产生的影响
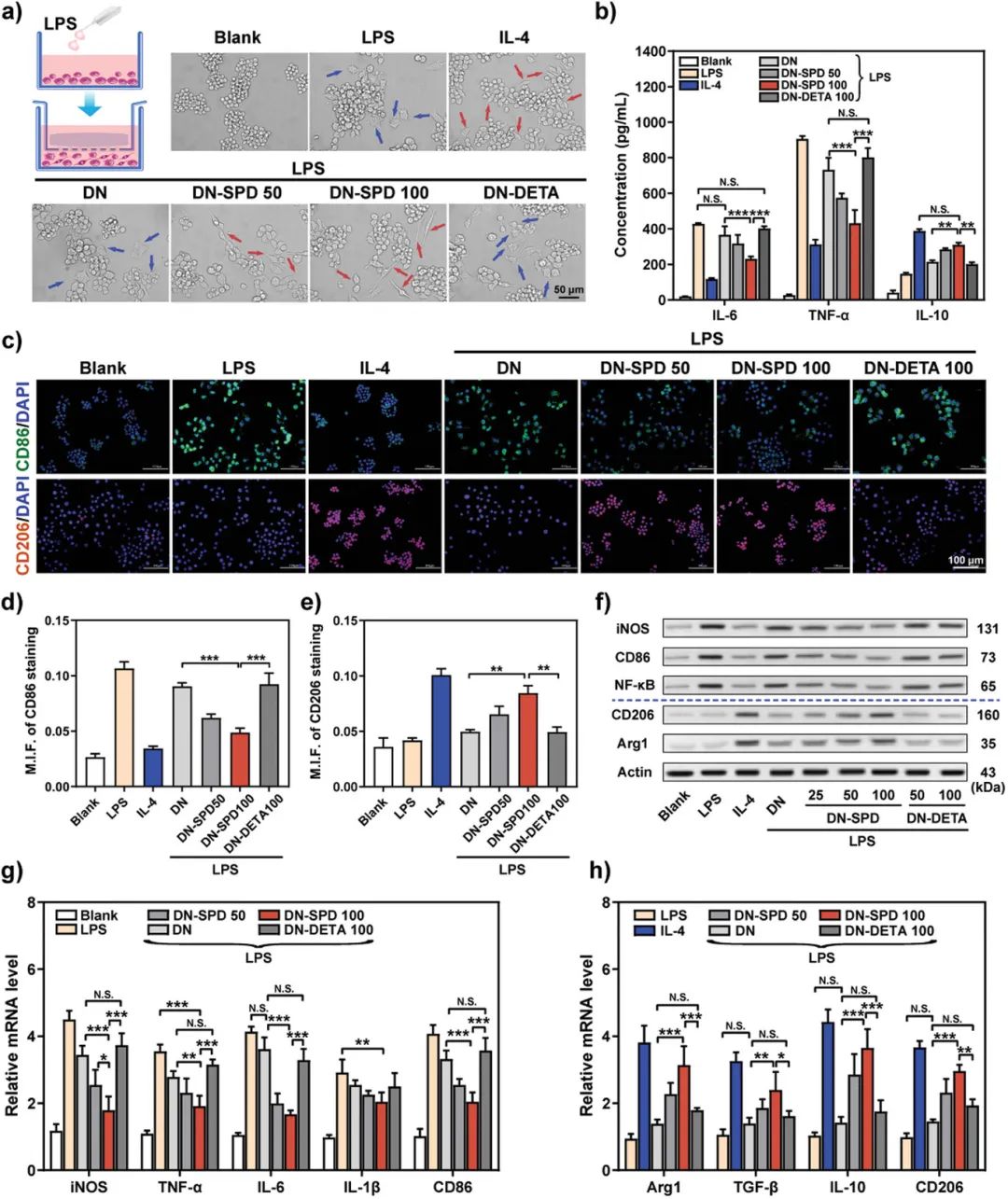
图4. 亚精胺功能化可注射双网络水凝胶对巨噬细胞极化的体外调控
要点三:亚精胺功能化的可注射水凝胶在植入大鼠体内后表现出较弱的免疫原性,水凝胶周围组织沉积较少,炎症反应程度显著减弱,与未植入材料的假手术组相近。相反,未负载SPD和负载DETA的可注射水凝胶周围组织出现肿胀和发炎,并有大量组织沉积,表现出严重的排异炎症反应。此外,SPD功能化可注射水凝胶能够抑制创面ROS过度产生,降低氧化应激水平,并且促进巨噬细胞向抗炎M2表型极化,从而防止促炎M1型巨噬细胞在创面过度积累,加速炎症期向增殖期过渡。同时,在增殖期SPD功能化可注射水凝胶能够促进伤口部位胶原再生、新生血管网络化构建及加速表皮新生,从而实现急性和糖尿病创面更快和更好的愈合,使得再生皮肤更接近于天然皮肤。
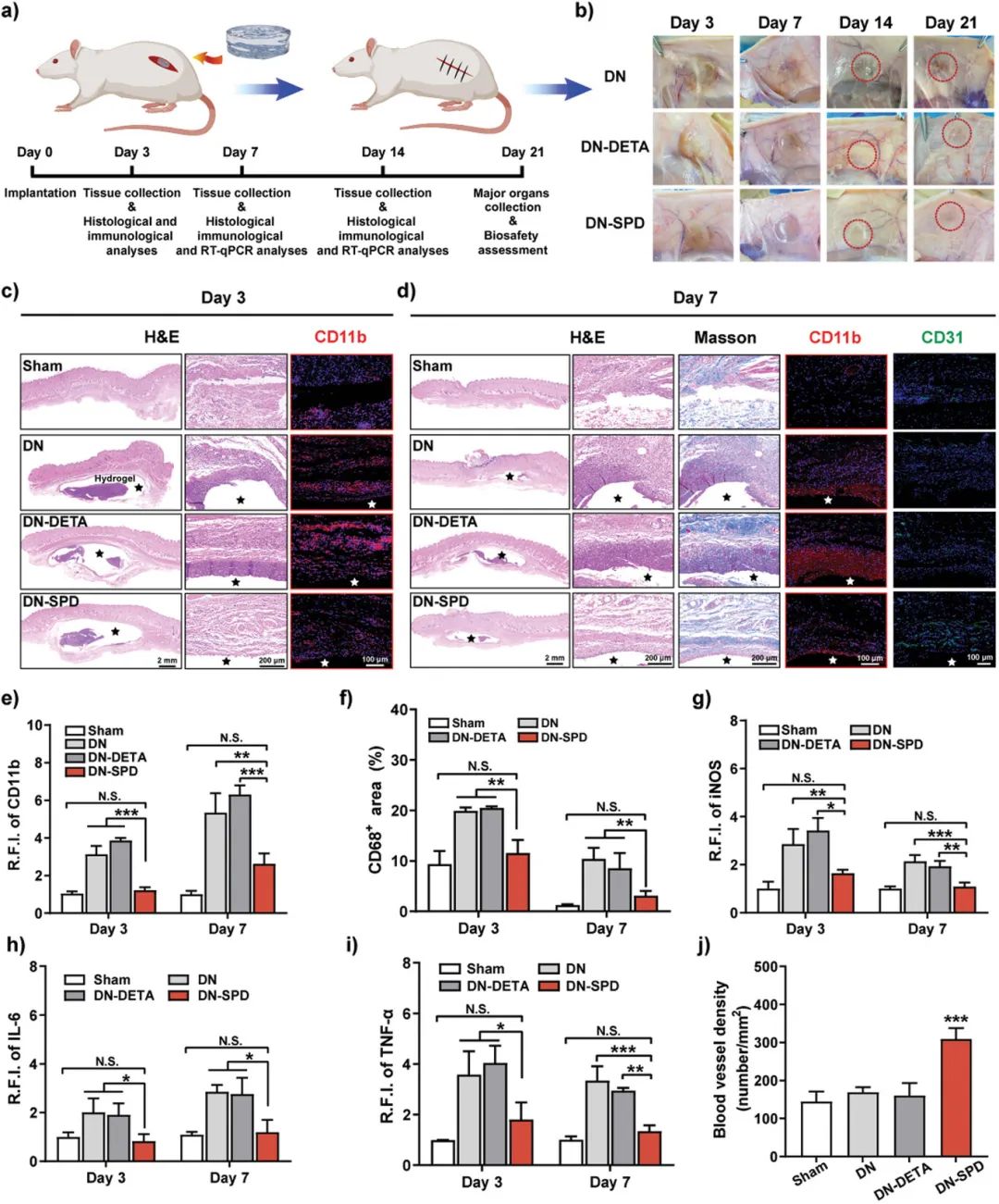
图5. 亚精胺功能化可注射双网络水凝胶在大鼠体内的免疫调控作用

图6. 亚精胺功能化可注射双网络水凝胶促进小鼠急性创面愈合
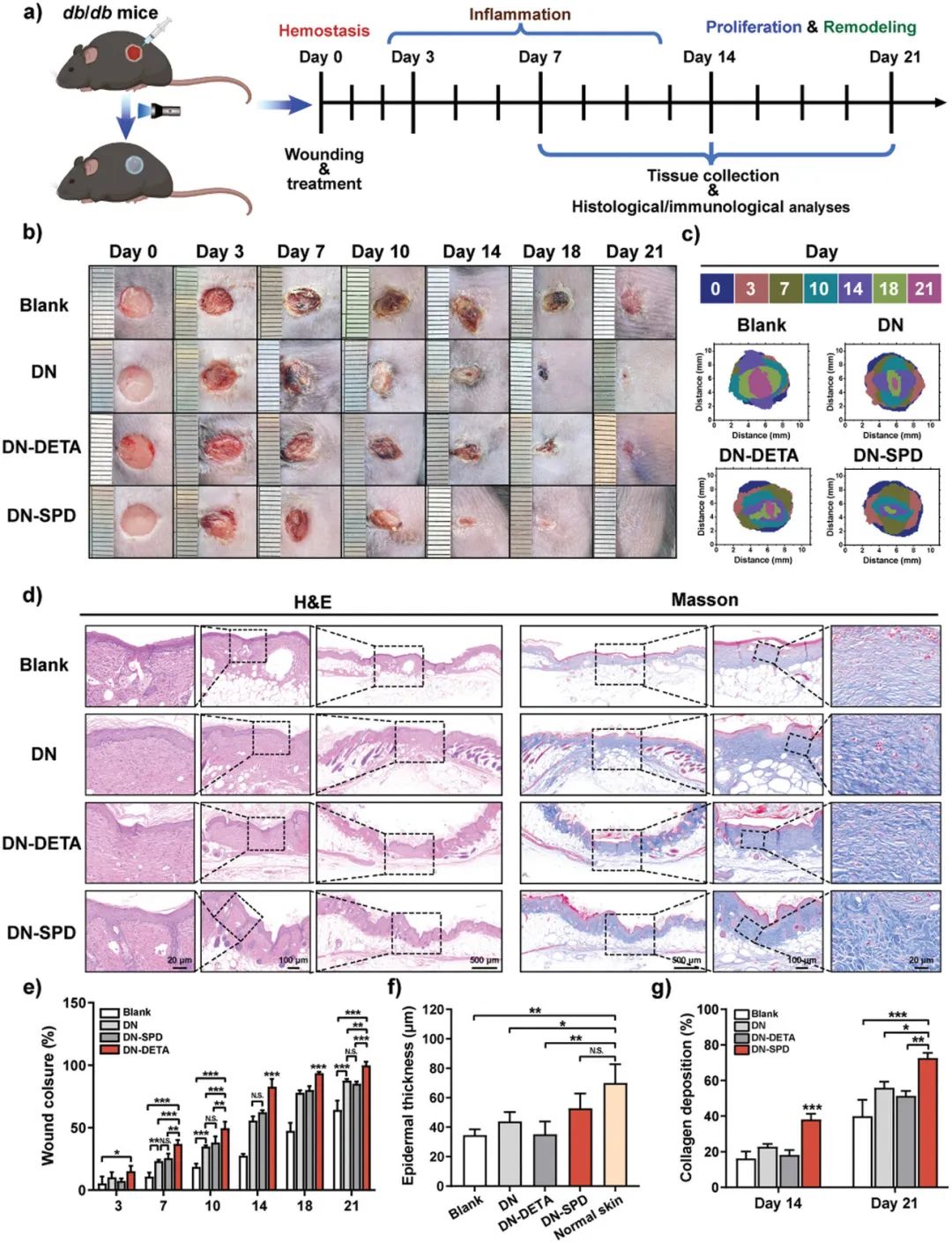
图7. 亚精胺功能化可注射双网络水凝胶原位促进db/db糖尿病小鼠创面愈合
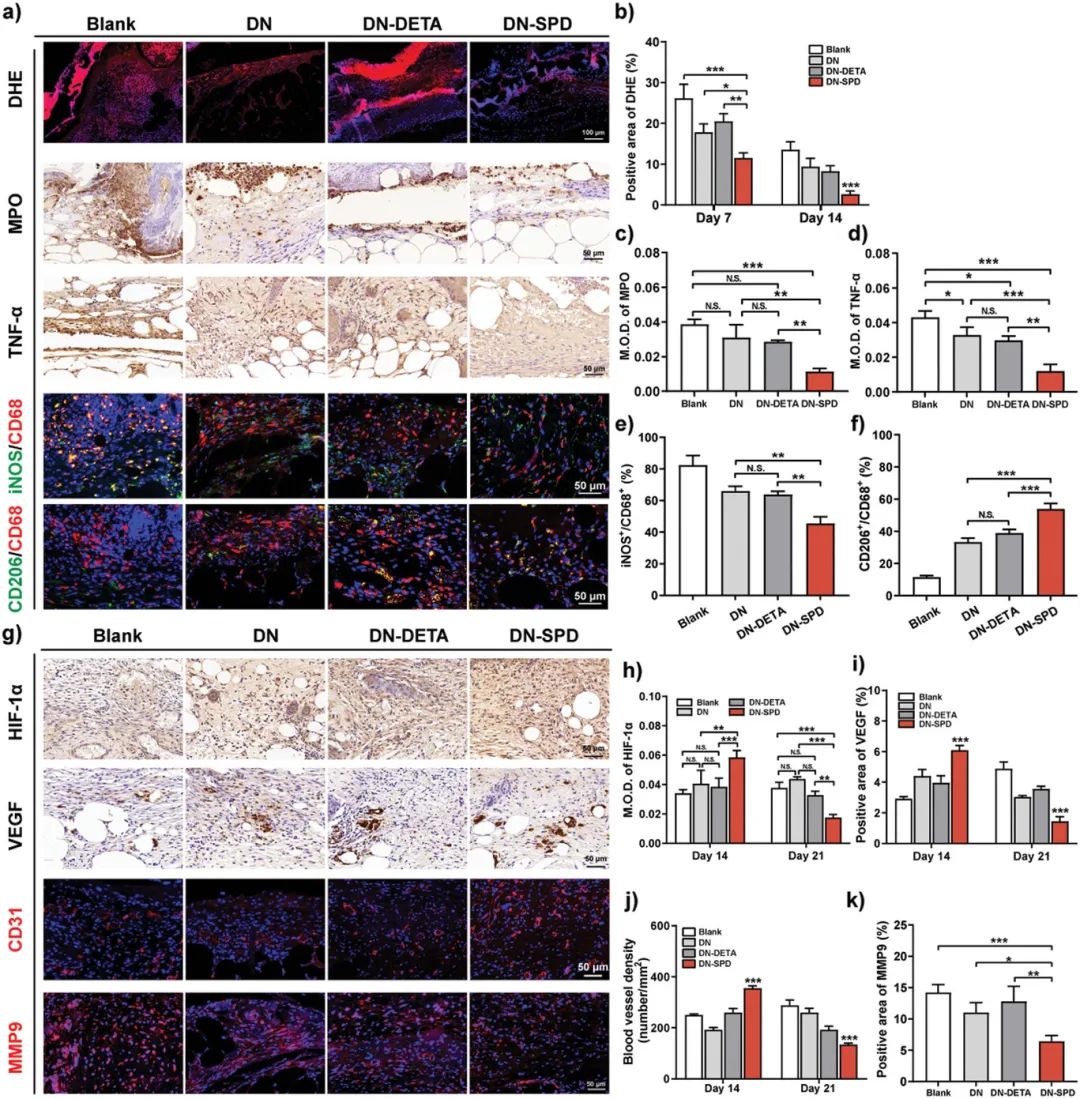
图8. 亚精胺功能化可注射双网络水凝胶在糖尿病小鼠创面愈合中的免疫调节作用
综上所述,该研究团队成功开发了一种具有仿生抗排异免疫调控功能的可注射双网络水凝胶。这种水凝胶兼具优异的可注射性和理想的机械性能,不仅能够通过免疫调控作用减少植入生物材料和ROS引起的炎症反应,还能促进急性和糖尿病创面的修复。该研究结果表明,在植入生物材料中局部施用亚精胺为减弱植入物诱发的免疫排异反应和治疗慢性难愈合创面提供了一种简单而优雅的方法。
该研究得到国家重点研发计划项目(2022YFE0138500)、国家自然科学基金项目(51975245和21975097)、吉林省科技发展计划项目(20200404166YY)和吉林大学科技创新研究团队项目(2020TD-03)资助。
论文信息:
Qianqian Wu, Runjiao Yang, Wenxuan Fan, Li Wang, Jing Zhan, Tingting Cao, Qiming Liu, Xianshu Piao, Yinghui Zhong, Wenxian Zhao, Shuhan Zhang, Jiaao Yu, Song Liang, Thomas M. Roberts, Bingdi Wang*, Zhenning Liu*. Spermidine-Functionalized Injectable Hydrogel Reduces Inflammation and Enhances Healing of Acute and Diabetic Wounds In Situ. Adv. Sci. 2024, 2310162, doi.org/10.1002/advs.202310162.
原文链接:
https://doi.org/10.1002/advs.202310162
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









谢谢分享
67
#水凝胶# #亚精胺# #糖尿病伤口#
135