Nat Biomed Eng :单碱基编辑首次在治疗遗传性眼病上取得成功,安全高效治疗先天性黑蒙症
2020-10-22 生物世界 Bio生物世界
先天性黑蒙症(LCA)是一类因影响视网膜功能的几个重要基因的功能丧失突变引起的遗传性视网膜疾病,主要为常染色体隐性遗传。大多数LCA患者在婴儿期或儿童期就开始出现严重的视力障碍。
先天性黑蒙症(LCA)是一类因影响视网膜功能的几个重要基因的功能丧失突变引起的遗传性视网膜疾病,主要为常染色体隐性遗传。大多数LCA患者在婴儿期或儿童期就开始出现严重的视力障碍,并且由于进行性视网膜变性,一般在30-40岁时会彻底失明。
直到近年来基因疗法的快速发展,这种严重的视网膜遗传病才有了可用的治疗方法。
2017年12月10日,FDA批准了Spark公司的AAV基因疗法,通过腺相关病毒(AAV)载体,将正确的RPE65基因递送到视网膜细胞,用于治疗先天性黑蒙2型。
早期临床试验表明,患者接受AAV基因治疗后第一年视觉功能有所改善,但之后,AAV载体的递送的转基因表达水平可能会随时间下降,RPE65蛋白缺乏引起的视网膜变性也会对外源表达RPE65蛋白有抵抗力。
因此,在DNA层面修复基因突变位点,才是治疗先天性黑蒙症一劳永逸的方法。
2020年10月19日,加州大学欧文分校的研究人员在 Nature 子刊 Nature Biomedical Engineering 杂志发表了题为:Restoration of visual function in adult mice with an inherited retinal disease via adenine base editing 的研究论文。
该研究使用慢病毒载体递送腺嘌呤单碱基编辑器(ABE),实现了对先天性黑蒙症小鼠模型突变基因的高效修复,有效恢复了小鼠模型视觉能力,且未发现可检测的脱靶效应。
这项工作表明,单碱基编辑技术可以替代基因增强疗法,以永久挽救因突变而失能的关键蛋白的功能,或修正无法使用基因增强疗法的显性遗传病。这项工作也代表了治疗遗传性视网膜疾病的新方向。
先天性黑蒙症2型,是因为RPE65基因的3号外显子上的一个单碱基突变,引起蛋白转录提前终止。
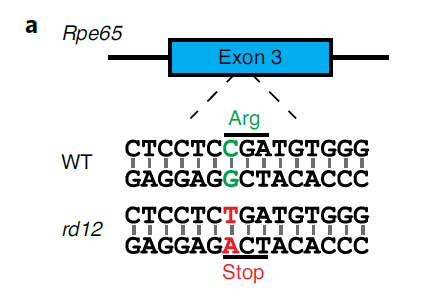
首先,研究团队在体外细胞实验中尝试用同源重组修复(HDR)的方式,尝试替换基因突变的DNA片段,实现对突变位点的修复,但效率非常低,不足1%,不足以恢复RPE65的功能,更不足以改善疾病表型。
因此,研究团队将希望放在了单碱基编辑器ABE上,研究团队向四周龄的先天性黑梦症小鼠模型视网膜注射慢病毒载体的腺嘌呤碱基编辑器(LV-ABE),注射量为每只小鼠眼球1E6 TU,研究团队选择慢病毒而非AAV病毒作为递送载体的原因是,慢病毒携带载体容量更大,能够最大化转导ABE系统,以获取单碱基编辑的最大功效。

此外,该研究还发现,当通过视网膜下注射到小鼠眼中时,慢病毒还表现出对视网膜的特异性靶向,从而无需组织特异性启动子。
注射后五周,研究团队检测基因修复效果,深度测序表明,最好的基因修复效率达到了29%,而且,研究团队表示,这一数据实际上是被低估了,因为用于测序的视网膜细胞样本中还包括了解剖带来的的未暴露于慢病毒的脉络膜和巩膜细胞。因此,实际上对视网膜的DNA修复的效率要更高。
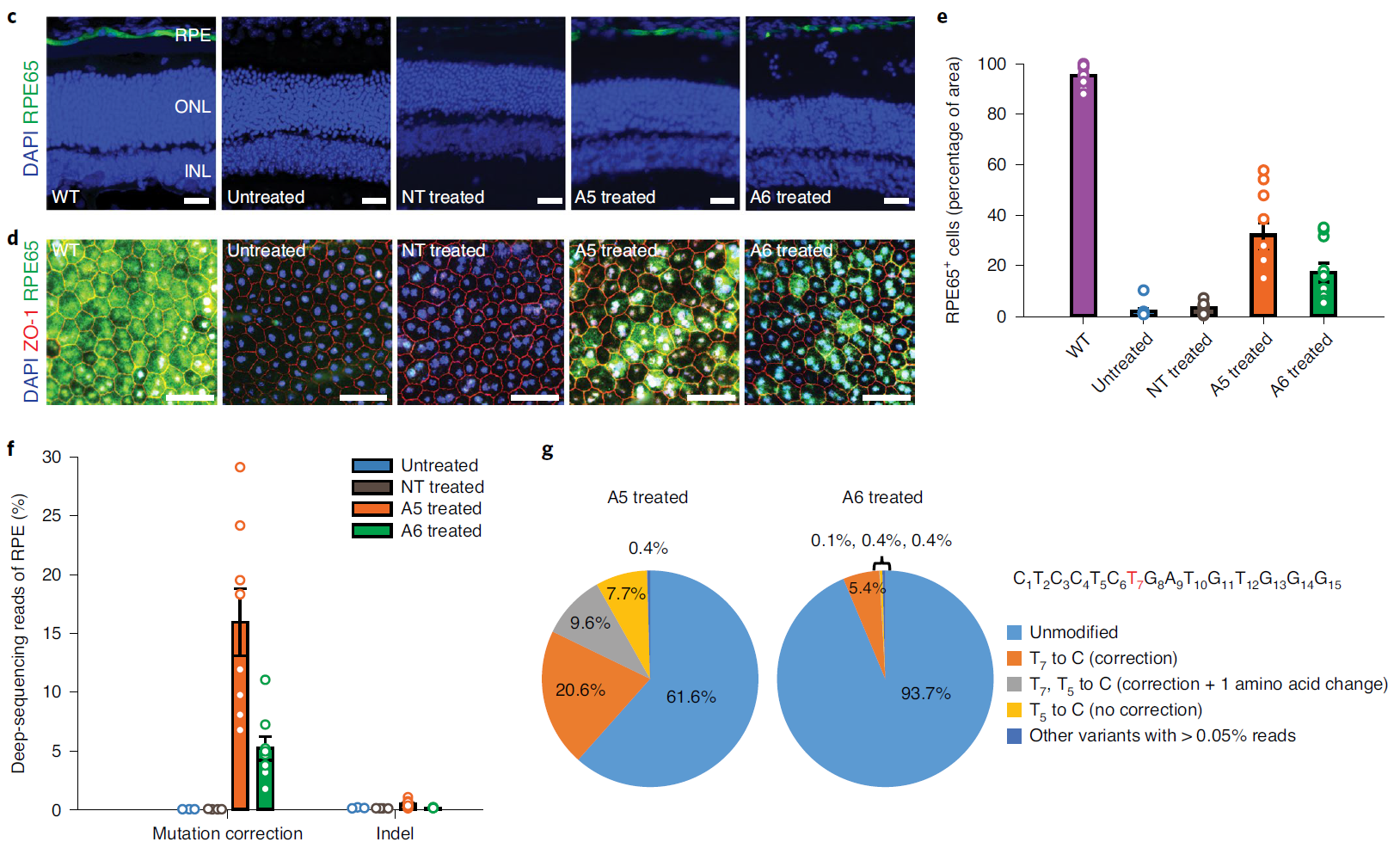
单碱基编辑的临床应用中面临的最大问题就是脱靶性,因此,研究团队进一步检测了脱靶效率,结果表明,均未发现在背景水平以上的脱靶性。
目前人类已发现至少75000种致病性基因突变,各种工程化改造的单碱基编辑器理论上可以修复其中95%的转换突变(transition mutations)或65%的点突变(point mutations),这项研究为通过单碱基编辑技术治疗多种形式的遗传性视网膜疾病奠定了基础。
该研究表明,单碱基编辑技术可以替代基因增强疗法,以永久挽救因突变而失能的关键蛋白的功能,或修正无法使用基因增强疗法的显性遗传病。这项工作也代表了治疗遗传性视网膜疾病的新方向。
目前CRISPR基因编辑治疗遗传性视网膜疾病进展最快的则是张锋创立的Editas Medicine公司。
Editas Medicine的治疗先天性黑蒙症10型的EDIT-101疗法,目前已处于早期临床试验阶段,已完成患者给药。
先天性黑蒙症10型,最常见的是因为CEP290基因的26号内含子发生点突变,导致转录提前终止。
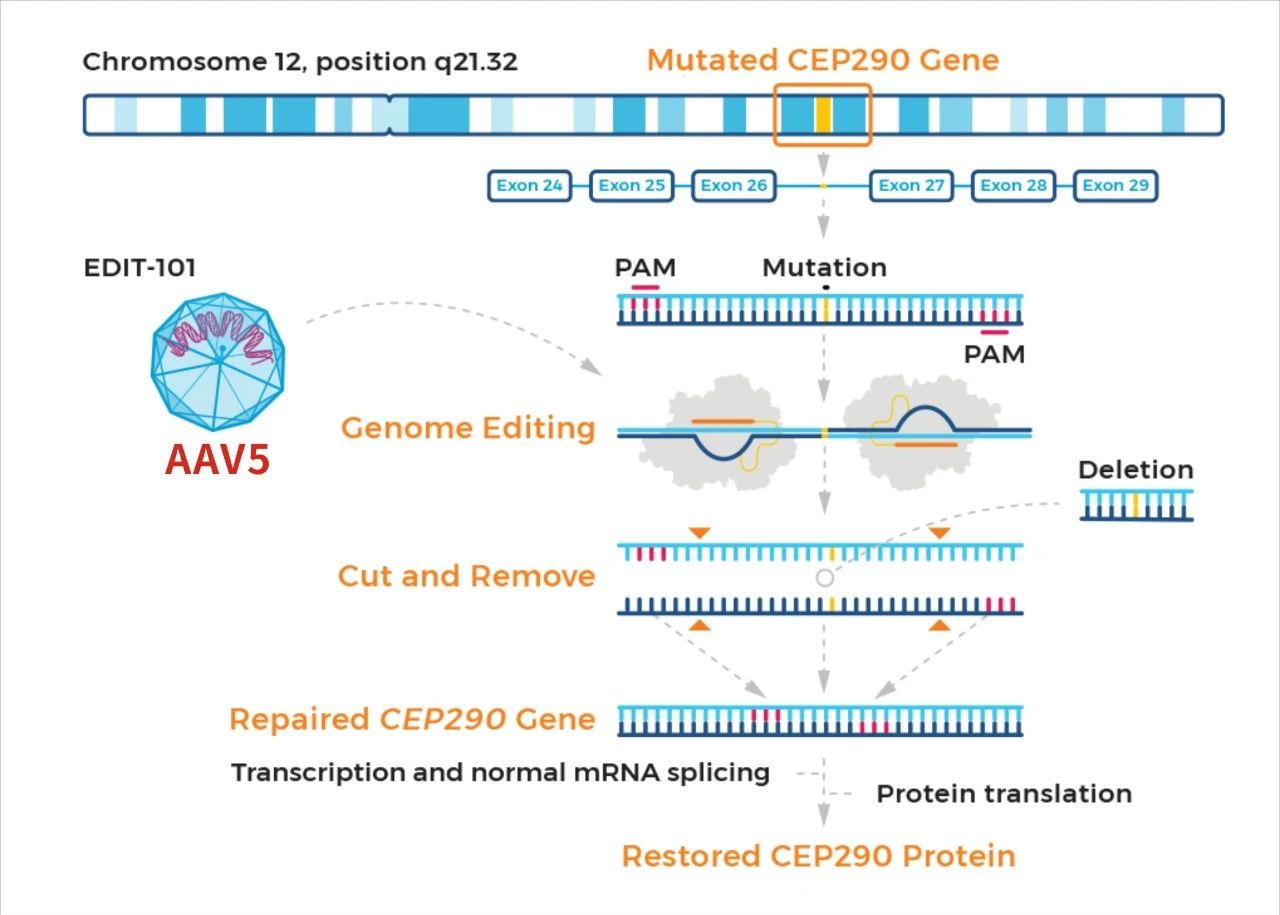
该疗法并未使用单碱基编辑技术,而是通过AAV5载体将saCas9和CEP290特异性gRNA递送至视网膜,通过双gRNA分别靶向突变内含子区域的上下游,直接将突变内含子区域整体删除或倒位,从而恢复CEP290基因的正常表达,进而让眼睛重获光明。
原始出处:
Susie Suh, Elliot H Choi, Henri Leinonen, et al.Restoration of visual function in adult mice with an inherited retinal disease via adenine base editing.Nat Biomed Eng. 2020 Oct 19. doi: 10.1038/s41551-020-00632-6.
作者: 生物世界
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#遗传性#
72
#Eng#
73
#Nat#
71
#Bio#
66
#先天性#
63