Nat Commun:“不要吃我”-福建医科大学陈实/田毅峰/王族伟揭示胰腺导管腺癌转移的调控新机制
2024-07-21 iNature iNature
该研究揭示了坏死通过逃避免疫监视促进PDAC转移,也表明CD47阻断结合MLKL抑制剂GW80672X可能是克服T1M1困境和恢复根治性手术机会的一种有希望的新辅助免疫治疗。
胰腺导管腺癌(PDAC)是一种毁灭性的癌症,由于远处转移,即使在早期,预后也很差。
2024年7月18日,福建医科大学陈实、田毅峰及王族伟共同通讯在Nature Communications 在线发表题为“Necroptosis enhances ‘don’t eat me’ signal and induces macrophage extracellular traps to promote pancreatic cancer liver metastasis”的研究论文,该研究揭示了坏死通过逃避免疫监视促进PDAC转移,也表明CD47阻断结合MLKL抑制剂GW80672X可能是克服T1M1困境和恢复根治性手术机会的一种有希望的新辅助免疫治疗。
通过RNA测序和多重免疫荧光,研究发现早期肝转移T期(T1M1)患者与非转移患者(T1M0)相比,混合谱系激酶结构域样伪激酶(MLKL)表达升高,PDAC中坏死途径增强。在机制上,MLKL驱动的坏死吸收巨噬细胞,增强肿瘤CD47“不吃要我”信号,并诱导巨噬细胞胞外陷阱(MET)形成以激活CXCL8。CXCL8进一步启动上皮-间质转化(EMT),上调ICAM-1表达,促进内皮细胞粘附。METs也降解细胞外基质,最终支持PDAC肝转移。同时,靶向坏死和CD47可减少体内肝转移。

胰腺导管腺癌(PDAC)是一种毁灭性的癌症,通常诊断得太晚,难以有效治疗,导致预后不良。PDAC的主要挑战之一是高发生率的转移,特别是向肝脏转移,发生在疾病的早期T阶段(T1M1),影响近10%的患者。不幸的是,早期肝转移患者不适合根治性切除,生存率非常低。尽管正在进行研究,但对PDAC早期肝转移的潜在机制仍然知之甚少。
早期肿瘤细胞受到来自抗肿瘤免疫反应的应激源,并且人们认为对细胞死亡的抵抗是获得转移表型所必需的。研究假设肝转移伴随小的原发性PDAC肿瘤大小可能涉及细胞死亡的抵抗力增加,可能是通过坏死。坏死是一种受调控的程序性细胞死亡,在此过程中,混合谱系激酶结构域样伪激酶(MLKL)发生磷酸化和低聚,导致胞浆孔的形成和细胞内物质的不受控制的释放。坏死性凋亡的激活理论上可以减缓肿瘤的进展,但其可能具有促肿瘤或抗肿瘤的作用,这取决于MLKL激活后的肿瘤及其微环境。MLKL在PDAC中的作用尚不清楚。
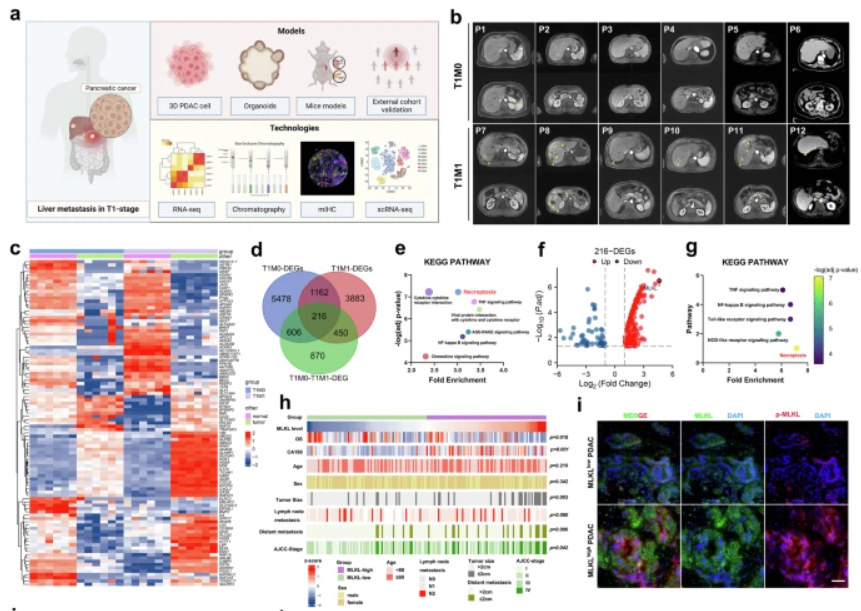
MLKL异常升高介导的程序性坏死与早期T期PDAC肝转移相关(图源自Nature Communications)
坏死性凋亡触发的细胞内物质释放塑造了TME,吸引了吞噬细胞,主要是肿瘤相关巨噬细胞(TAMs),后者是先天免疫和适应性免疫的桥梁。M1和M2 TAMs对肿瘤有不同的作用。尽管M1 TAMs具有抗肿瘤作用,但肿瘤细胞在复杂的TME中适应,并受到致瘤因子和抗肿瘤因子之间平衡的影响。巨噬细胞表型在坏死细胞驱动的TME事件中的确切作用尚不清楚。此外,肿瘤细胞使用“不要吃我”信号,如通过CD47-SIRPα轴或CD24-Siglec10轴介导的信号,阻断TAM的抗原呈递。TAM还可以产生巨噬细胞胞外陷阱(MET),其类似于中性粒细胞胞外陷阱(NET),由纤维染色质骨干结构的复杂网络组成。尽管有报道表明NETs可以唤醒休眠的肿瘤细胞并促进肿瘤转移,但对肿瘤背景下的METs的了解非常有限,正如对坏死和METs之间相互作用的了解一样。
在研究中分析了早期T期PDAC伴肝转移患者的多维数据,揭示了程序性坏死的促进转移作用,这是由MLKL表达异常升高驱动的。这一过程增强了肿瘤CD47“不要吃我”信号并诱导MET形成,这在多个转移阶段发挥了至关重要的作用。在临床前模型中,与CD47一起靶向坏死可防止PDAC肝转移。这些发现阐明了一种新的巨噬细胞激活的在坏死状态下的逃避方式,并为早期T期PDAC合并肝转移提供了一种有希望的新辅助策略,解决了一个紧迫的临床挑战。
参考消息:
https://www.nature.com/articles/s41467-024-50450-6
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肝转移# #胰腺导管腺癌# #CD47# #PDAC# #新辅助免疫治疗#
79