国家药监局综合司关于严厉打击非法制售新冠肺炎病毒检测试剂的通知
2020-03-28 国家药监局综合司 国家药监局综合司
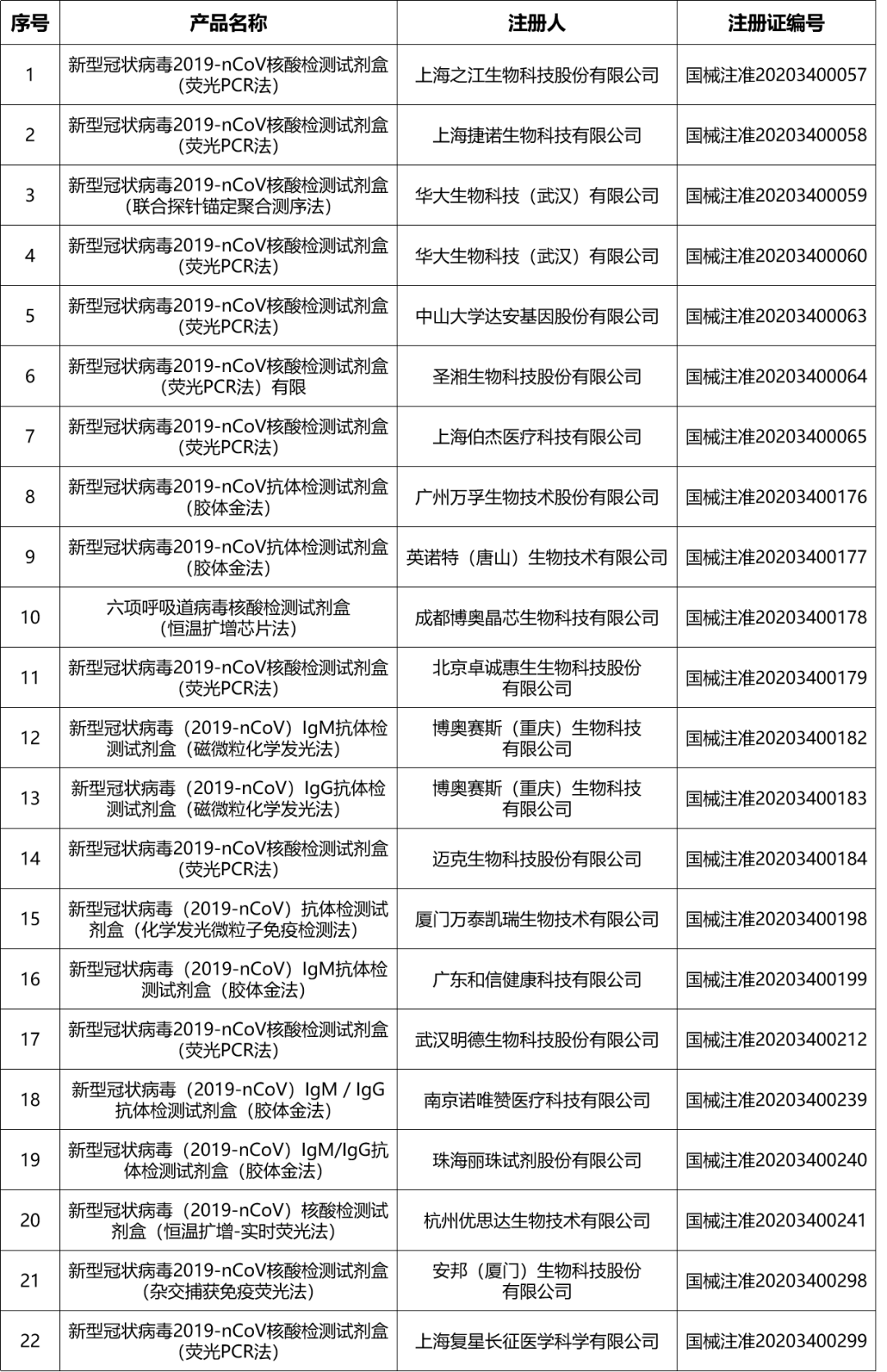
截至3月26日,国家药监局已完成22个新型冠状病毒检测试剂盒,进一步扩大了检测试剂的供应,服务疫情防控需要。近来,出现个别未经注册的相关检测试剂产品进行虚假宣传的情况,国家药监局综合司发布相关通知。
各省、自治区、直辖市药品监督管理局,新疆生产建设兵团药品监督管理局:
新冠肺炎疫情暴发以来,国家药监局已批准22个检测试剂产品注册,不断满足疫情防控需要。近期发现,个别未经注册的相关检测试剂产品进行虚假宣传,严重扰乱市场秩序。为有效净化市场环境,切实保障公众健康权益,现就严厉打击非法制售新冠肺炎病毒检测试剂等医疗器械违法违规行为有关要求通知如下:
一、 各级药品监督管理部门要切实落实药品安全“四个最严”要求,按照《国家药监局综合司关于切实做好新型冠状病毒感染的肺炎防控用药用械质量监管工作的通知》(药监综电〔2020〕2号)等文件部署,加大对相关诊断试剂生产、经营企业、医疗器械网络交易服务第三方平台及网络销售企业监督检查力度。对违法违规线索,各级药品监督管理部门要及时组织查处,并将查处情况报送国家药监局。
二、 各级药品监督管理部门要高度重视通过网络监测、投诉举报、舆情监测、监督检查、部门通报等渠道反映的案件线索,深挖细查。对未经许可从事生产、经营活动的,生产、经营未经注册批准相关检测试剂产品的,要依法从严从快查处。对医疗器械网络第三方平台经营者未履行对入驻电商的登记核查等义务的,未对平台内相关虚假信息及时处置的,要约谈告诫并限期整改。对拒不整改或者整改不到位的,要依法严肃查处,并予以曝光。
三、各级药品监督管理部门要加强与公安、网信、通信主管等部门的协调配合,对发布虚假信息,生产销售非法新冠肺炎病毒检测试剂等产品的网站、APP等,要及时通报网信、通信主管部门;对涉嫌犯罪的,要依法及时移送公安机关。
国家药品监督管理局已批准的新冠肺炎病毒检测试剂相关信息,可通过国家药监局官方网站(http://www.nmpa.gov.cn/)动态查询。发现有违法违规行为的,请及时向12315投诉举报。
国家药监局综合司
2020年3月26日
已上市应急IVD产品汇总
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#新冠肺炎病毒#
46
#检测试剂#
50
#药监局#
43
#国家药监局#
43
#病毒检测#
33