Nat Commun:北京大学陶伟课题组揭示表观遗传信号通路在细胞衰老和心脏老化中的关键作用
2018-07-03 胖胖同学 iNature
2018年7月2号,北京大学陶伟课题组等人在Nature Communications上在线发表了题为“TGF-β signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging”的研究论文。研究人员表明,典型的TGF-β信号通过miR-29诱导的H4K20ME
2018年7月2号,北京大学陶伟课题组等人在Nature Communications上在线发表了题为“TGF-β signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging”的研究论文。研究人员表明,典型的TGF-β信号通过miR-29诱导的H4K20ME3的丧失促进衰老。同时研究也进一步介绍了衰老调控的顺序机制,从衰老诱导的触发到激活反应性的信号传导,随后是特异性的表观遗传改变,从而揭示心脏衰老中潜在的治疗干预措施。
细胞衰老主要表现为细胞增殖停滞、衰老相关β-半乳糖苷酶(SA-β-GAL)1的积累、衰老相关分泌表型(SASP)的出现和细胞周期素依赖性激酶抑制剂(CKI)的表达。细胞衰老是由大量的细胞外和细胞内激发素触发的,它在病理或生理上参与年龄有关的疾病、肿瘤抑制和组织形态。衰老过程是通过内源和外源衰老诱导信号引导的多种调控网络来协调的。
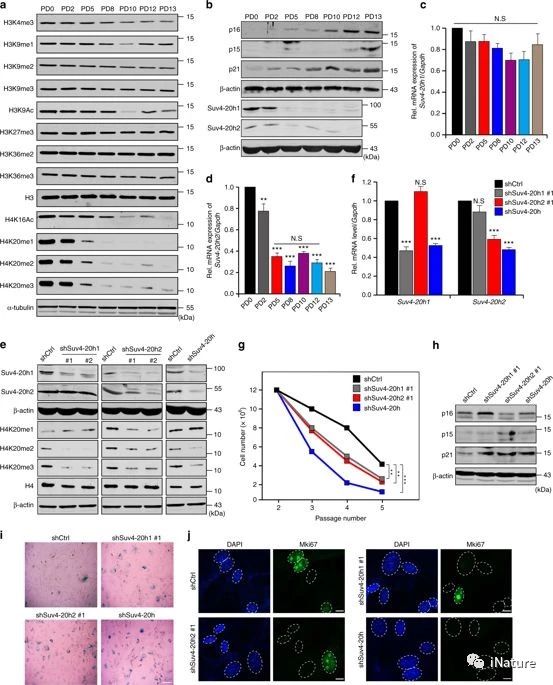
H4K20me3的缺失促进细胞衰老
转化生长因子β/smad信号通路是调控损伤性衰老和发育程序性衰老的重要途径之一。这一途径在进化上是保守的,参与了影响细胞周期控制、伤口愈合、骨形态发生、癌变、肿瘤抑制和分化等多种生理活动的大量生物学过程。转化生长因子TGF-β结合后,II型(TβRII)和I型受体(TβRI)激酶发生一系列复杂的形成和磷酸化事件,激活TβRI,然后通过磷酸化受体调控的pSmad 2/3和共同介质Smad 4的复合物形成信号转导通路。接下来,Smad复合物被转移到细胞核中,通过物理相互作用和与其他协同因子17的功能合作来调控下游靶基因的转录。体内和体外模型证实,sapp或其它发育线索激活的转化生长因子-β信号通过上调p15和(或)p21在损伤和发育衰老过程中调节衰老。这些结果表明,转化生长因子-β通路在衰老过程中起着重要作用,是环境胁迫和内源性信号介导衰老信号的关键传感器之一。
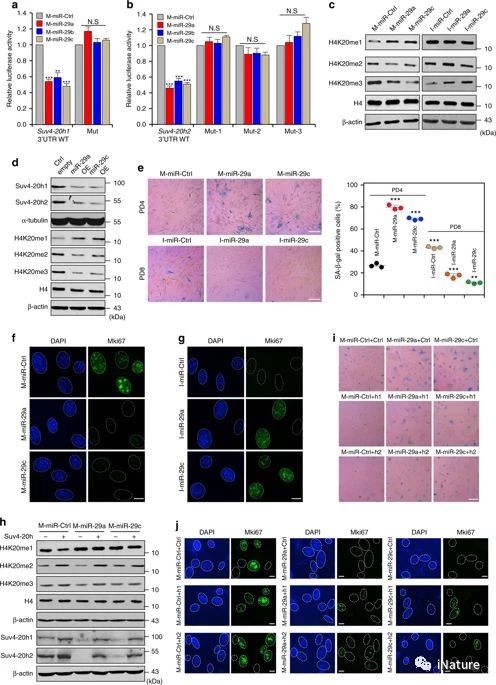
miR-29介导的H4K20me3的减少导致过早的细胞衰老
表观遗传学以DNA甲基化,组蛋白修,染色质异构和RNA干扰的形式参与衰老,并被广泛认为是衰老的标志。表观遗传改变通过影响DNA损伤修复、端粒长度和代谢途径或激活衰老相关基因和miRNAS 的表达而影响衰老。多种证据表明染色质状态的改变与细胞衰老的控制密切相关。细胞可以感觉到不同的衰老刺激,这些刺激会激活信号通路,驱动染色质状态的改变。然而,衰老信号引起这种改变的途径仍然很大程度上是未知的。
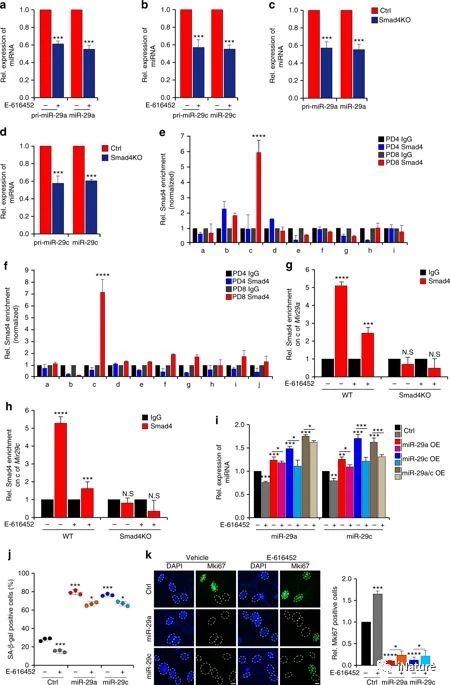
在MEFs衰老期间,TGF-β信号传导以Smad依赖性方式调节miR-29表达
在这里,研究人员表明,典型的TGF-β信号通过miR-29诱导的H4K20ME3的丧失促进衰老。机械作用下,氧化应激可触发TGF-β信号传导。激活的TGF-β信号转导导致miR-29a和miR-29c的急性积累,两者都直接抑制它们的新靶,Suv4-20h,因此以Smad依赖性方式减少H4K20ME3丰度,这损害了DNA损伤修复和基因组维护。通过衰老的TGF-β/miR-29途径介导的H4K20ME3的丧失有助于体内的心脏衰老。TGF-β信号的破坏恢复H4K20ME3,改善老龄小鼠心脏功能。该研究重点介绍了衰老调控的顺序机制,从衰老诱导的触发到激活反应性的信号传导,随后是特异性的表观遗传改变,从而揭示心脏衰老中潜在的治疗干预措施。
原始出处:
Guoliang Lyu,et al.TGF-β signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging.Nat Commun.02 July 2018
作者:胖胖同学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录




#COMMUN#
59
#中的关键作用#
60
#北京大学#
95
#Nat#
97
#细胞衰老#
51