Sci Transl Med:烟酸受体HCAR2调节小胶质细胞应答和AD进展
2022-10-19 brainnew神内神外 brainnew神内神外
将烟酸受体HCAR2调节小胶质细胞反应和AD进展联系起来。并在5xFAD小鼠中使用FDA批准的烟酸 (Niaspan) 制剂激活HCAR2,从而减少斑块负荷和神经元营养不良、减少神经元损失并改善记忆缺
烟酸受体HCAR2在大脑中选择性由小胶质细胞上表达,而饮食中烟酸摄入量的增加与阿尔茨海默病(AD)风险的降低有关。近期,《Science Translational Medicine》期刊发表了题为“The niacin receptor HCAR2 modulates microglial response and limits disease progression in a mouse model of Alzheimer’s disease”的论文,作者团队揭示了一种新的机制,将烟酸受体HCAR2调节小胶质细胞反应和AD进展联系起来。并在5xFAD小鼠中使用FDA批准的烟酸 (Niaspan) 制剂激活HCAR2,从而减少斑块负荷和神经元营养不良、减少神经元损失并改善记忆缺陷,从而减轻淀粉样蛋白诱导的病理学,这表明使用Niaspan可能是一种很有前景的治疗AD的方法,特别针对神经免疫反应。

AD患者小胶质细胞对HCAR2的诱导作用
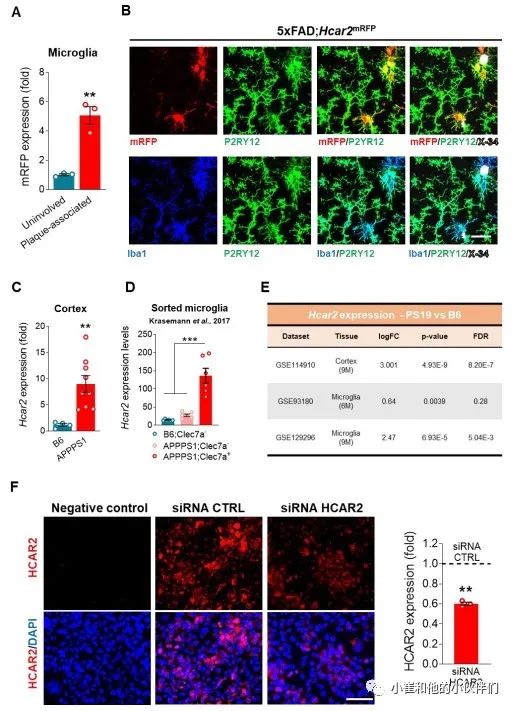
为了检查GPCR HCAR2在AD中的表达是否改变,作者分析了5xFAD淀粉样蛋白小鼠模型和人类AD脑组织中Hcar2 mRNA的表达(图1)。在4~6个月大的雌性和雄性5xFAD动物的海马和皮层中,Hcar2的表达在斑块活跃沉积期间增加(图1A)。为了确定Hcar2的表达是否与小胶质细胞特异性相关,作者团队使用CSF1R拮抗剂PLX5622在4个月大的5xFAD小鼠中耗尽了小胶质细胞细胞 。并发现耗竭大约70%的皮质小胶质细胞会降低了5xFAD大脑中的Hcar2 mRNA表达(图 1B,左)。此外,当停用CSF1R拮抗剂(PLXon-off)后,会导致小胶质细胞的再增殖和Hcar2表达的恢复(图 1B,右)。这些结果表明,诱导5xFAD大脑中Hcar2表达与小胶质细胞之间有着特异的相关关系。可能Hcar2 mRNA表达增加的根本原因是小胶质细胞的增生 ,作者团队分析了来自 8.5个月大的5xFAD小鼠的分选小胶质细胞的转录组数据集,发现在5xFAD大脑中的小胶质细胞内Hcar2表达增加(图 1C,顶部)。此外,将原代鼠小胶质细胞与5 μM的Aβ1-42聚集体一起孵育24小时导致Hcar2表达显著增加(P<0.001)(图 1C,底部),与之前的研究结果一致。为了观察5xFAD大脑中Hcar2的诱导,作者团队将5xFAD小鼠与在内源性小鼠Hcar2 (5xFAD;Hcar2mRFP) 表达单体红色荧光蛋白报告基因 (mRFP) 的小鼠进行杂交,此前已报道该杂交方法能准确反映Hcar2表达,并用于研究小胶质细胞中Hcar2的表达。随后4个月大的 B6、5xFAD以及Hcar2mRFP动物的免疫组织化学(IHC)显示,Hcar2表达仅限于Iba1阳性小胶质细胞(图 1D),但是与未被Aβ斑块受累的小胶质细胞相比,在Aβ斑块周围的细胞中其表达显着增加(图 S1A)。由于mRFP和Iba1都与小胶质细胞特异性标志物P2RY12共定位(图 S1B),证实Hcar2是由5xFAD大脑中的大脑驻留小胶质细胞诱导的,这与先前的研究一致,也表明在这个模型中没有外周单核细胞浸润到脑实质 。作者团队还在4个月大的APPPS1淀粉样蛋白生成小鼠模型的大脑中观察到诱导生成的Hcar2 mRNA (图 S1C)。此外,已发表的对来自APPPS1模型的分选小胶质细胞的转录组分析显示,与Aβ斑块(Clec7a-;图 S1D)无相关的小胶质细胞相比,Hcar2 mRNA在与Aβ斑块相关的小胶质细胞[C 型凝集素结构域含有 7a (Clec7a)+] 中选择性地增加,这结果与作者团队在5xFAD模型中的结果一致。转录组数据分析显示,PS19 tau蛋白病小鼠的小胶质细胞中Hcar2表达增加(图 S1E),表明tau病理也可以在AD中诱导HCAR2表达。

图1 AD患者小胶质细胞对HCAR2的诱导作用
作者团队分析了人类转录组数据中157名非痴呆对照组受试者和310名AD患者 (GSE33000)的背外侧前额叶皮层(BA9)组织的人类转录组数据集。结果显示AD中HCAR2表达增加(图 1E)。并且通过qPCR反应(图 1E)分析对照受试者和AD患者的死后脑组织样本中的HCAR2表达来验证这一发现。非痴呆对照(CTRL)和AD患者死后脑切片的IHC显示HCAR2蛋白表达对Iba1阳性细胞具有选择性,并且在AD中显著增加(P<0.05)(图 1F),这与作者团队在5xFAD模型中的发现一致(图 1D)。然而,正如在淀粉样蛋白小鼠模型(图 1D 和图 S1B)中观察到的那样,人类AD脑中HCAR2的诱导似乎并不局限于淀粉样蛋白斑块的周围环境(图 1F),这可能是因为tau(图 S1C)等其他触发因子的强健和广泛存在,但也可能由抗体的非特异性相互作用引起。鉴于许多GPCR抗体的非特异性免疫反应,作者通过小干扰RNA介导的人类小胶质细胞系HMC3中HCAR2的敲除来评估抗-HCAR2抗体的特异性,这导致HCAR2免疫反应的相应降低(图 S1E)。总的来说,这些发现支持HCAR2由大脑中的小胶质细胞选择性表达,这与RNA测序(RNA-seq)数据集和之前确认HCAR2基因为人类核心小胶质细胞特征的一部分相一致。此外,这些数据表明,AD患者大脑中存在HCAR2的诱导作用。
图S1 5xFAD小鼠脑内Hcar2诱导、APPPS1和PS19小鼠模型中Hcar2表达以及Hcar2抗体ab81825的验证
缺乏Hcar2会干扰淀粉样变5xFAD大脑中的小胶质细胞活动
淀粉样蛋白沉积在AD进展的早期就开始了,在症状出现前几十年已经引发了包括HCAR2表达增加在内的小胶质细胞反应。因此,作者团队试图通过5xFAD淀粉样变性模型中HCAR2的基因失活的方法,来研究HCAR2在淀粉样变病理中的作用。作者团队将5xFAD与Hcar2-/-动物杂交,获得了缺失Hcar2基因的5xFAD小鼠(5xFAD;Hcar2-/-)。在Hcar2-/-动物的脑组织和原代培养的小胶质细胞中证实了Hcar2的缺失(图 S2A)。利用NANOSTRING公司的神经胶质细胞图谱分析了6个月龄雌性5xFAD、Hcar2+/+和5xFAD、Hcar2-/-小鼠的海马区组织中的RNA。差异表达基因(DEGs)[调整(adj.)P<0.05]如热图(图 2A)所示。Hcar2的失活导致40个基因的显著下调(adj.P<0.05),未发现显著上调的基因(adj.P>0.05)。胶质特征分析小组中包含在小胶质细胞、星形胶质细胞、少突胶质细胞和神经元中表达的基因。然而,与其他细胞类型相比,由于Hcar2失活而下调的基因有一半以上是在小胶质细胞中选择性表达的,如Barres RNA-Seq数据集(图 2A)所述,这与HCAR2对大脑中小胶质细胞的特异性(图 1)一致。此外,对生物过程(GO-BP)和WikiPathways的基因本体术语的富集分析表明,缺乏Hcar2会抑制与免疫激活和反应相关的路径,尤其是吞噬作用和跨膜免疫信号适配器TYROBP路径(图 2B)。此外,GO细胞组分富集分析表明,细胞表面和膜组分的表达降低,这与免疫反应和吞噬作用降低一致(图 2B)。Hcar2缺失时突触成分的减少也表明对神经元功能有影响(图 2B)。作者团队通过qPCR验证了在5xFAD;Hcar2+/+和5xFAD;Hcar2-/-中参与小胶质细胞反应和吞噬的几个DEG(SPP1、Cst7、CD68、TREM2、Tyrobp和Ax1)的减少。作者团队还分析了它们在非转基因B6;Hcar2+/+和B6;Hcar2-/-中的表达(图 2C)。正如预期的那样,与B6对照组相比,5xFAD小鼠的这些基因显著增加;然而,这种诱导被Hcar2缺失而抑制(Cst7,CD68,TREM2和Tyrobp),甚至被取消(Spp1和Ax1)(图 2C)。作者团队通过qPCR观察到B6、Hcar2+/+和B6、Hcar2-/-之间的基因表达没有变化,表明Hcar2不影响非病变脑组织中的这些通路。总体而言,这些数据表明,缺乏Hcar2导致小胶质细胞对淀粉样蛋白病理的反应不足,这与吞噬功能和TYROBP信号的降低显著相关。
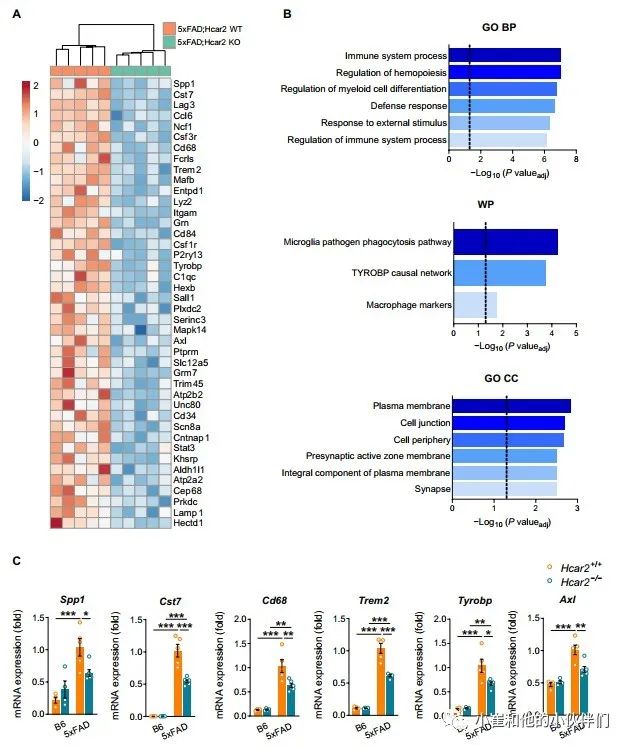
图2 缺乏Hcar2会干扰淀粉样变5xFAD大脑中的小胶质通路
缺乏Hcar2会减少小胶质细胞与斑块的接触,增加斑块负担
作者团队对5xFAD;Hcar2+/+和 5xFAD:Hcar2-/-小鼠进行了进一步的功能和表型分析,以了解观察到的转录差异(图 2)如何有效地转化为小胶质细胞反应的改变和淀粉样蛋白病理的严重程度。因此,作者团队研究了Hcar2对5xFAD 大脑中斑块病理和小胶质细胞-斑块相互作用的影响。在 5xFAD 模型中,海马下托区域表现出最早和最具侵略性的淀粉样蛋白积累 。作者团队观察到硫代黄素S 阳性斑块的数量显着增加(P<0.05),并且这些斑块在4月龄和6月龄缺失Hcar2的雌、雄5xFAD小鼠的下托区中所占据的面积也增加(图 3A 和图 S 3A-B)。4个月龄动物的海马区(不包括下托)斑块负荷略有增加(图 S3C)和Hcar2缺失的6月龄雌性5xFAD小鼠的大脑皮质(图 S3A),同时伴有星形细胞增多(图 S3D)。4月龄的5xFAD;Hcar2-/-小鼠下托中斑块负荷的增加伴随着Iba1百分比面积减少(图 3B)。与之一致的是Hcar2 的失活导致4个月大的5xFAD的海马中Aif1表达降低,但在非转基因对照 (B6) 小鼠中没有出现(图 3B),表明这种效应在未患病的大脑中是不存在的。作者团队通过IHC进一步检测6个月大的5xFAD小鼠在疾病后期中小胶质细胞对淀粉样蛋白病理的反应。与4个月大的动物相似, Hcar2的缺失会减少下托中Iba1百分比的面积(图 3C),伴随着斑块的小胶质细胞包膜减少(图 3C)。在 5xFAD;Hcar2-/-小鼠的皮质中观察到类似的减少(图 3D)。作者团队量化了每个斑块周围25 μm半径内的小胶质细胞丰度,以评估小胶质细胞向斑块的募集,发现在没有Hcar2的情况下显著减少(P<0.001)(图 3E)。总体而言,这些数据支持Hcar2的缺失导致小胶质细胞覆盖不足和与斑块的接触不足,这与较高的斑块负担有关。
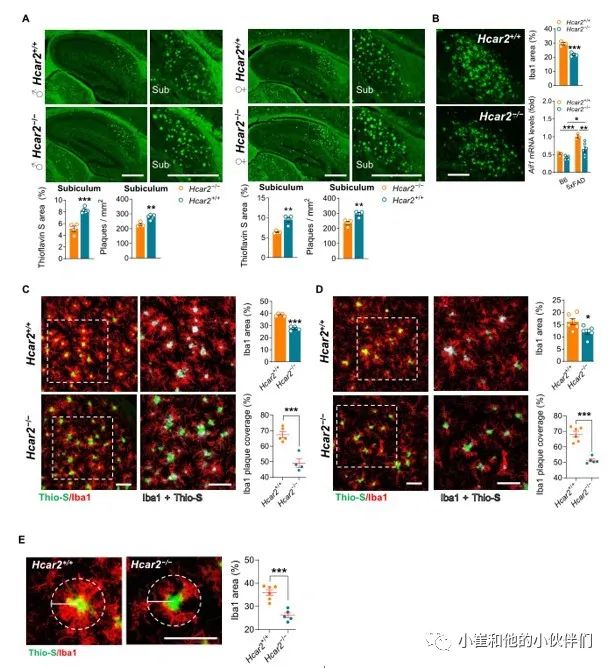
图3 缺乏Hcar2会减少小胶质细胞与斑块的接触,增加斑块负担
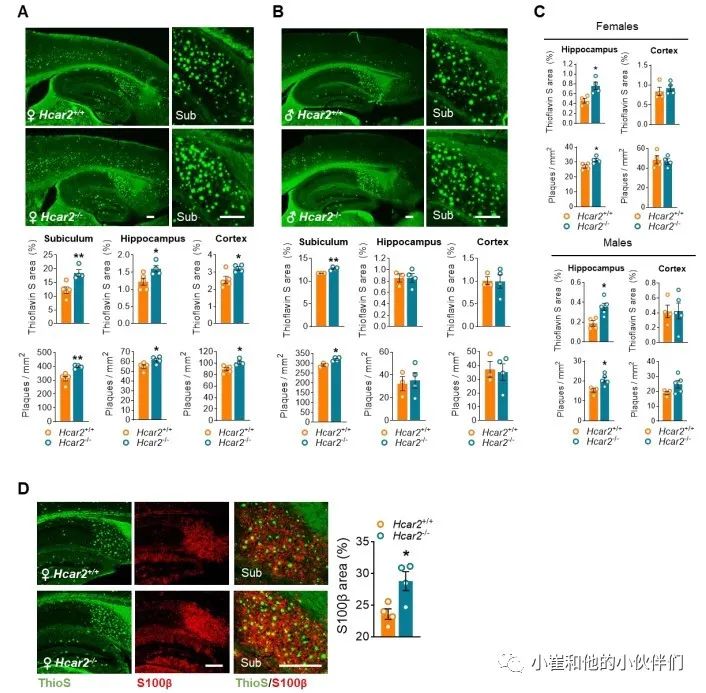
图S3 缺乏Hcar2会增加5xFAD小鼠的斑块负担和星形细胞增多
Hcar2是小胶质细胞高效增殖和淀粉样蛋白摄取所必需的
作者团队观察到5xFAD;Hcar2-/-小鼠中的小胶质细胞反应受到抑制,导致斑块负担加重。因为小胶质细胞占据的区域在5xFAD;Hcar2-/-与5xFAD;Hcar2+/+小鼠大脑中相比较,前者的区域减少了,所以作者团队假设HCAR2调节小胶质细胞的增殖以应对淀粉样蛋白病理变化。并且同时分析了 Hcar2 的缺失是否会影响4个月大的5xFAD动物大脑中增殖标记物Ki-67的表达。通过IHC,作者团队观察到缺乏Hcar2的5xFAD小鼠大脑中的Ki-67阳性小胶质细胞(Ki-67+/Iba1+)显著减少(P<0.05)(图 4A),表明增殖减少。Ki-67染色仅在细胞核内观察到(图 S4A)。因为小胶质细胞的增殖能力与吞噬活性的增加有关,所以在5xFAD;Hcar2-/-中观察到这种增殖减少以及吞噬基因表达减少(图 2)和斑块负荷增加(图 3),表明缺乏Hcar2会导致Aβ吞噬功能缺陷。因此,作者团队通过流式细胞术检测了HCAR2如何影响5xFAD大脑中小胶质细胞和淀粉样蛋白摄取的总数。其通过在6个月大的5xFAD;Hcar2-/-和5xFAD;Hcar2+/+动物腹膜内施用甲氧基-X04(Aβ标记物)进行了体内小胶质细胞吞噬作用试验,如前所述,在进行流式细胞术前3小时。通过门控CD11b+细胞识别小胶质细胞(图 S4B),与小胶质细胞覆盖率和增殖减少一致,作者团队观察到与5xFAD;Hcar2+/+动物相比,5xFAD;Hcar2-/-动物的小胶质细胞数量显著减少(P<0.05)(图 4B)。根据CD45的表达,小胶质细胞可分为CD45low(活性较低)和CD45int(活性较高)(图 S4C)。 Hcar2失活显著减少了CD45int人群中的细胞数量(P<0.05),对CD45low细胞没有显著影响(P=0.09)(图 4C)。因此,正如预期的那样,Hcar2的缺失降低了总小胶质细胞群(CD11b+)中CD45int细胞的比例,同时增加了CD45low细胞的比例,这表明缺乏Hcar2限制了由淀粉样蛋白病理触发的小胶质细胞的激活(图 4C)。小胶质细胞数量(CD11b+细胞)的减少还伴随着该群体在5xFAD;Hcar2-/-动物中 Aβ摄取(甲氧基-X04+)的全面减少(图 4D)。在Hcar2敲除动物中,甲氧基-X04 阳性CD11b+细胞的百分比仅轻微降低(图 S4C),这表明HCAR2对小胶质细胞吸收Aβ的内在能力影响很小。然而,该分析可能无法准确反映HCAR2对Aβ吸收影响的整体大小。5xFAD;Hcar2-/-动物吞噬Aβ的细胞百分比可能会升高,这纯粹是因为这些小鼠依靠较少的小胶质细胞清除更多的Aβ,这可以掩盖其固有的淀粉样蛋白摄取能力的缺陷。因此,为了进一步研究HCAR2是否影响小胶质细胞摄取Aβ的内在能力,作者团队培养了来自Hcar2+/+和Hcar2-/-小鼠的原代小鼠小胶质细胞,并用FDA批准的烟酸(Niaspan)配方在1 mM下培养细胞24小时以激活HCAR2,然后用1.25uM的HiLyte Fluor 488标记的Aβ1-42聚集体培养30分钟。作者团队的结果表明,Aβ1-42的基础摄取在Hcar2-/-小胶质细胞中减少(图 4E)。此外,Niaspan 处理增加了Hcar2+/+细胞中Aβ1-42的摄取,但不增加Hcar2-/-小胶质细胞(图 4E),证实烟酸通过HCAR2作用以增加Aβ摄取。此外,用较低浓度的烟酸 (100 uM) 处理Hcar2+/+小胶质细胞也导致 Aβ摄取的显著增加 (P<0.05),这在 Hcar2-/-细胞中未观察到(图 S4E)。这些结果与之前的研究结果一致,HCAR2刺激小胶质细胞吞噬小球和髓鞘碎片。总之,这些数据表明,在淀粉样病变的背景下,HCAR2是小胶质细胞有效增殖和Aβ摄取所必需的。
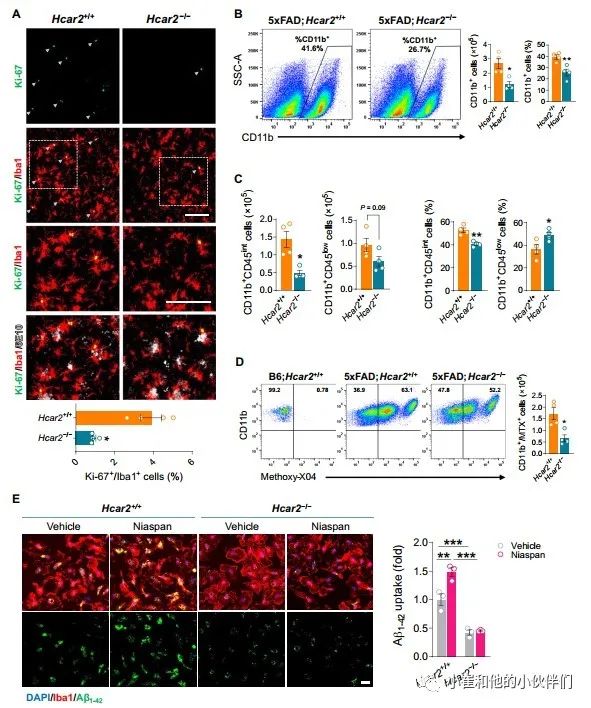
图4 Hcar2是小胶质细胞高效增殖和淀粉样蛋白摄取所必需的
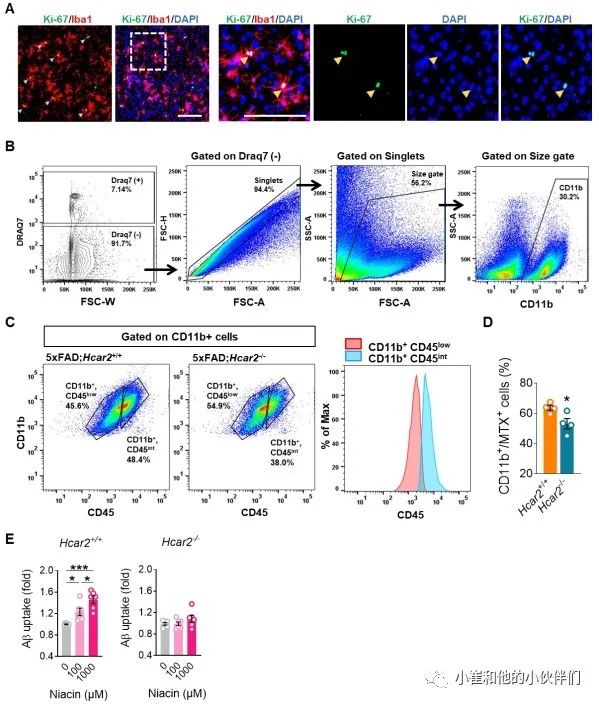
图S4 5xFAD;Hcar2+/+和5xFAD;Hcar2-/-小鼠小胶质细胞的增殖和流式细胞术分析以及Niaspan对体外Aβ摄取的影响
Hcar2缺乏会加重淀粉样蛋白相关神经病理学
作者团队的转录组分析表明,与5xFAD;Hcar2+/+小鼠相比,5xFAD;Hcar2-/-中的神经元功能受损(图 2B)。作者团队使用 Y 迷宫任务评估了B6和5xFAD小鼠(Hcar2+/+和Hcar2-/-)的工作记忆。该测定法已广泛用于5xFAD模型,该模型显示在大约4到5个月大时开始出现工作记忆的严重缺陷 。作者团队分析了4个月大的小鼠,虽然工作记忆障碍在5xFAD;Hcar2+/+这个年龄的动物中仍然不明显,但缺乏Hcar2的5xFAD小鼠已经表现出明显的缺陷(P<0.05),这与手臂条目的数量无关(图 5A)。将雌性和雄性小鼠一起分析,因为作者团队在这个年龄的每个基因型中没有观察到性别依赖性差异。作者团队还评估了所有基因型在Y迷宫任务期间的运动技能(速度和距离)和焦虑样行为(时间不动),发现没有显著差异(P>0.05;图 S 5A)。
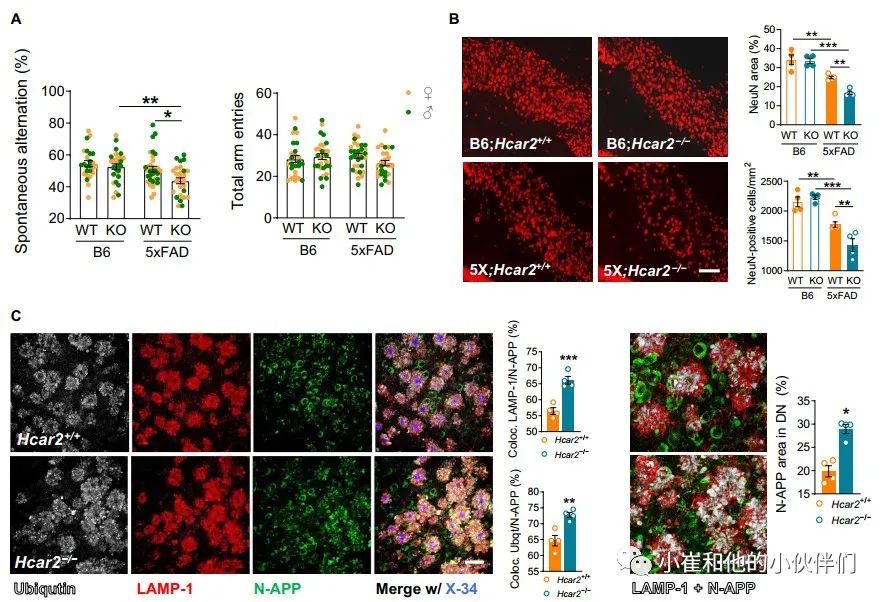
图5 Hcar2缺乏会加重淀粉样蛋白相关神经病理学
在5xFAD模型中,随着疾病的进展,下托会经历严重的神经元损失。NeuN阳性细胞的IHC分析显示,与5xFAD;Hcar2+/+小鼠相比,4个月大的5xFAD;Hcar2-/-小鼠下托神经元损失增加(图 5B)。营养不良性神经突 (DN) 是肿胀的异常神经突,在AD患者和5xFAD小鼠大脑内的Aβ沉积物附近大量存在 。DNs富含溶酶体相关膜蛋白1 (LAMP-1) 和泛素并积累神经元N端APP (N-APP) 。IHC分析显示,尽管5xFAD;Hcar2+/+和5xFAD;Hcar2-/-动物的LAMP-1和泛素的百分比面积保持相似,但在5xFAD;Hcar2-/-的基底细胞内,LAMP-1与泛素与N-APP的共定位增加(图 S5B)。与之一致的是对单个DNs内的N-APP染色的分析显示N-APP在5xFAD;Hcar2-/-小鼠中的积累增加(图 5C)。作者团队发现DNs中较高的N-APP含量与减少的神经元数量之间存在显著相关性(P<0.05)(图 S5C)。这些结果表明,Hcar2的失活加剧了5xFAD中的神经元病理,包括与工作记忆缺陷加速发作相关的神经元损失增加。
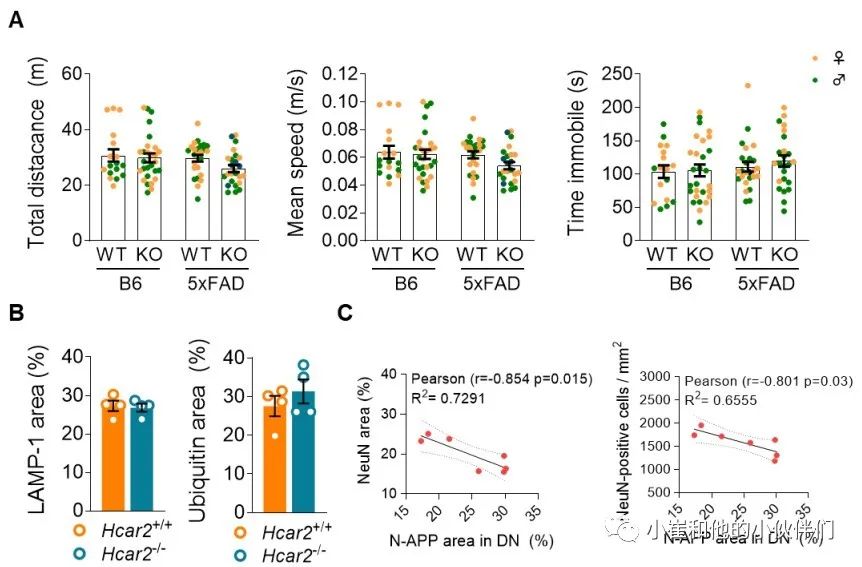
图S5 Hcar2+/+和Hcar2-/-小鼠的行为特征和营养不良神经突起分析
Niaspan激活HCAR2的药理作用降低5xFAD小鼠的淀粉样病变
为了确定HCAR2通过药物激活后是否可以在淀粉样蛋白病理发作后刺激有益的小胶质细胞反应,作者团队用FDA批准的烟酸口服制剂Niaspan治疗5xFAD动物。有充分证据表明,与雄性相比,雌性5xFAD小鼠表现出更具侵袭性的淀粉样蛋白病理。因为5xFAD雄性和雌雄都显示出类似的Hcar2表达增加,也同样表现出缺乏Hcar2加剧淀粉样蛋白病理(图 1、3 和 5),作者团队选择通过仅分析雄性小鼠的HCAR2激活的影响来消除性别依赖性的混淆影响。为了模拟疾病症状阶段的治疗,作者团队开始对5个月大的5xFAD动物进行Niaspan给药,这些动物已经表现出工作记忆缺陷(图 S6A)。通过口服灌胃法给动物服用Niaspan (100 mg/kg) 30天。该剂量导致给药后30分钟5xFAD脑中烟酸浓度显著增加(P<0.001)(≈6 倍)(图 S6B)。用Niaspan治疗5xFAD小鼠挽救了工作记忆缺陷和相关脑部区域,最突出的是不仅表现在下托,而且在海马和皮质中 (图 6B 和图 S6C)。此外,经治疗动物的基底膜中斑块尺寸减小(图 S6D)。作者团队还通过IHC观察到在Niaspan治疗的动物中,Iba1与小胶质细胞特异性标志物P2RY12完全共定位,这支持了这种治疗不会诱导外周来源的单核细胞浸润到5xFAD的脑实质中(图 S6E)。这些数据表明Niaspan能够减少5xFAD小鼠的斑块负荷和神经元病理。因为下托被证明是Niaspan治疗最敏感的区域,作者团队分析了该区域的小胶质细胞反应。在Niaspan治疗的动物后斑块负荷的减少伴随着Iba1百分比面积的轻度减少,尽管小胶质细胞的斑块覆盖率在载体和治疗动物之间保持相似(图 6D)。因为斑块和Iba1区域面积随着Niaspan治疗而减少,为了比较未治疗和治疗动物之间小胶质细胞对淀粉样蛋白沉积的反应,作者团队测定了小胶质细胞面积与斑块面积的比率。在Niaspan处理的小鼠中,Iba1面积/硫黄素S面积的比率增加(图 6E),这表明Niaspan诱导小胶质细胞更有效地动员以响应Aβ沉积。此外,发现与5xFAD;Hcar2-/-小鼠(图2)中斑块参与和淀粉样蛋白摄取下调相关的基因在Niaspan治疗小鼠的海马中增加(Trem2、Axl和Cd68)(图 6F)。作者团队将Mrc1添加到qPCR分析中,因为这种参与吞噬作用的小胶质细胞基因已被证明受HCAR2的调节,并且不包括在nCounter胶质细胞特征分析小组中。Mrc1随着Niaspan处理而增加(图 6F)。此外,Clec7a是AD中小胶质细胞与斑块结合的重要标志物,作者团队观察到Niaspan治疗显著诱导 (P<0.01) 它表达(图 6F),而对Hcar2-/-小鼠的NanoString分析显示对Clec7a表达没有影响。尽管未治疗和经治疗过的动物之间的斑块包膜相似,但Niaspan诱导的与斑块接触和淀粉样蛋白摄取相关的基因表明:小胶质细胞在减少淀粉样蛋白沉积方面的效率增加,这得到了作者团队的体外吞噬作用测定的支持(图 4E)。此外,使用Meso Scale Discovery (MSD) 细胞因子面板,作者团队观察到Niaspan对小胶质细胞的刺激不会引起脑细胞因子浓度的整体变化,除了干扰素-γ(IFN-γ) 的轻度增加(图 6G),据报道IFN-γ对 AD 具有潜在的有益作用 。
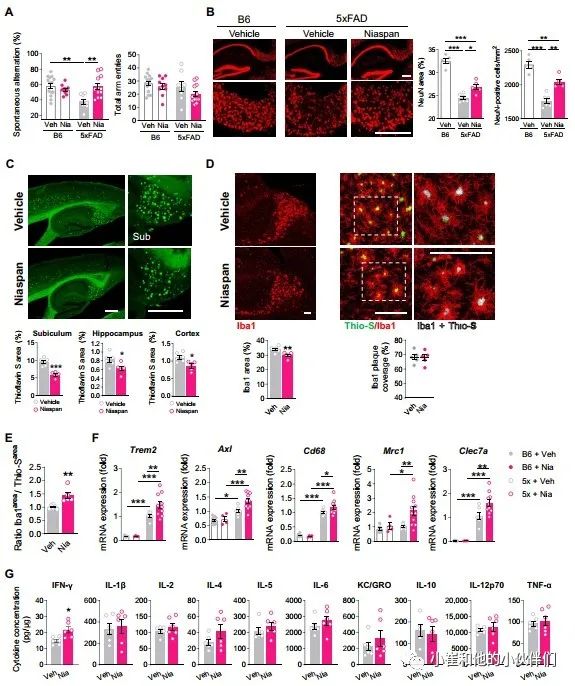
图6 Niaspan刺激AD小鼠的小胶质细胞反应并降低淀粉样病变
为了验证Niaspan通过HCAR2发挥其有益作用,作者团队使用5xFAD;Hcar2-/-小鼠评估了相同的剂量范式。在没有Hcar2的情况下,作者团队没有观察到用Niaspan治疗的5xFAD小鼠的工作记忆改善或神经元损失减少(图 7A-B)。此外,在5xFAD;Hcar2-/-小鼠中,Niaspan治疗既没有改变斑块负荷,也没有改变小胶质细胞覆盖率(图 7C-D)。在没有Hcar2的情况下,Niaspan介导的与斑块包膜和淀粉样蛋白摄取相关的基因诱导以及5xFAD;Hcar2+/+中观察到的IFN-γ增加被消除(图 7E-F)。这些观察结果表明,Niaspan通过HCAR2发挥作用以刺激有益的小胶质细胞反应并减弱淀粉样蛋白病理,这验证了靶向该受体作为AD的潜在治疗策略。
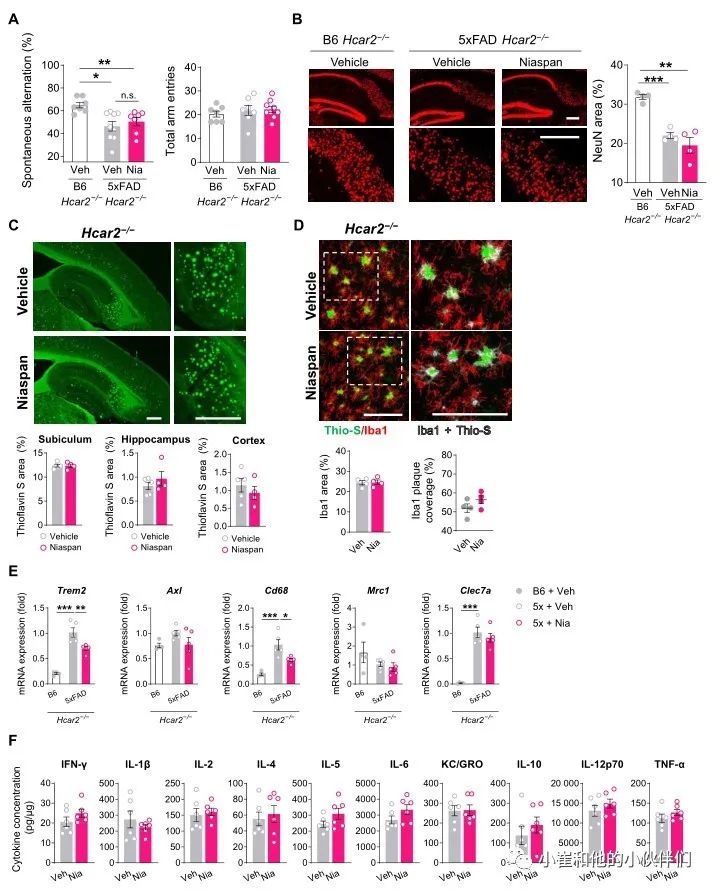
图7 Niaspan治疗对缺乏Hcar2的5xFAD没有疗效
小结
作者团队报告了一种治疗策略,通过烟酸受体HCAR2调节AD的小胶质细胞功能,这是有效的小胶质细胞对AD相关病理反应所必需的。并且证明了用FDA批准的烟酸制剂Niaspan激活HCAR2,可以减少斑块负担和神经元病理,并挽救5xFAD小鼠模型中的工作记忆缺陷。因此,烟酸是一种有希望的治疗AD的药物,具有很高的临床应用潜力。
原文:
Miguel Moutinho, Shweta S Puntambekar, Andy P Tsai, Israel Coronel, Peter B Lin, Brad T Casali, Pablo Martinez, Adrian L Oblak, Cristian A Lasagna-Reeves, Bruce T Lamb, Gary E Landreth. The niacin receptor HCAR2 modulates microglial response and limits disease progression in a mouse model of Alzheimer's disease. Sci Transl Med. 2022 Mar 23; 14(637):eabl7634. doi: 10.1126/scitranslmed.abl7634.
作者:brainnew神内神外
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言