读书报告 | 肿瘤微环境中Treg细胞具有保守的转录联接性
2023-10-29 iCombo iCombo
在自身免疫疾病和癌症中调节性T细胞通常被认为对抗原呈递细胞和效应T细胞发挥专职的抑制作用。近期研究发现Treg细胞在肿瘤微环境中发挥广泛的调控作用,可影响多种支撑肿瘤发展的附属细胞功能。
导读
在自身免疫疾病和癌症中调节性T(Treg)细胞通常被认为对抗原呈递细胞和效应T细胞发挥专职的抑制作用。近期研究发现Treg细胞在肿瘤微环境中发挥广泛的调控作用,可影响多种支撑肿瘤发展的附属细胞功能。多种研究模型显示,在Treg细胞被清除后,肿瘤细胞的生长在起初被抑制,但最终肿瘤出现进展。肿瘤进展的原因可能是Treg细胞清除后,其他肿瘤微环境中的其他细胞发挥“补偿”作用。因此,在Treg清除后,肿瘤微环境中其他细胞所产生的应答和基因表达变化可能影响肿瘤的预后。这种Treg细胞与微环境其他细胞在功能上相互依赖/相互补充的现象称为“Treg细胞的联接性”。
本研究为了阐明Treg和肿瘤微环境中其他附属细胞间的相互作用,利用基因编辑的小鼠模型,探索在Treg细胞清除后早期肿瘤微环境中关键附属细胞的转录组学变化,包括内皮细胞、成纤维细胞、单核细胞、巨噬细胞等。研究显示,Treg细胞是肿瘤微环境中造血和非造血来源的辅助细胞复杂网络中的重要组成部分。在不同疾病状态中观察到的细胞转录状态改变具有共同特征,Treg细胞和组织支持细胞网络的相互依赖性是保守的,阻断其相互依赖性可开发治疗癌症和其他疾病的新策略。例如,在PD1抗体耐药的NSCLC动物模型瞬时删除Treg细胞联合短期拮抗VEGF治疗的疗效优于单纯删除Treg细胞(Nat Immunol.2023 Jun;24(6):1020-1035. doi: 10.1038/s41590-023-01504-2)。
研究背景
在自身免疫和癌症中,调节性T(Treg)细胞通常被认为对抗原呈递细胞和效应T细胞发挥专职的抑制作用。但最近研究发现Treg细胞在肿瘤微环境中发挥广泛的调控作用,可影响多种支撑肿瘤发展的附属细胞类型。
多种研究模型都显示,在Treg细胞被清除后,肿瘤细胞的生长在起初被抑制,但最终肿瘤出现进展。肿瘤进展的原因可能是Treg细胞清除后,其他肿瘤微环境中的细胞发挥“补偿”作用。
因此,在Treg清除后,肿瘤微环境中其他细胞所产生的应答和基因表达变化可能影响肿瘤的预后。
研究目的和设计
为了阐明Treg和肿瘤微环境中其他附属细胞间的相互作用,利用基因编辑的小鼠模型,探索在Treg细胞清除后早期肿瘤微环境中关键附属细胞的转录组学变化,包括内皮细胞、成纤维细胞、单核细胞、巨噬细胞等。
研究结果
研究结果1:Treg清除后早期TME中主要细胞亚群的变化
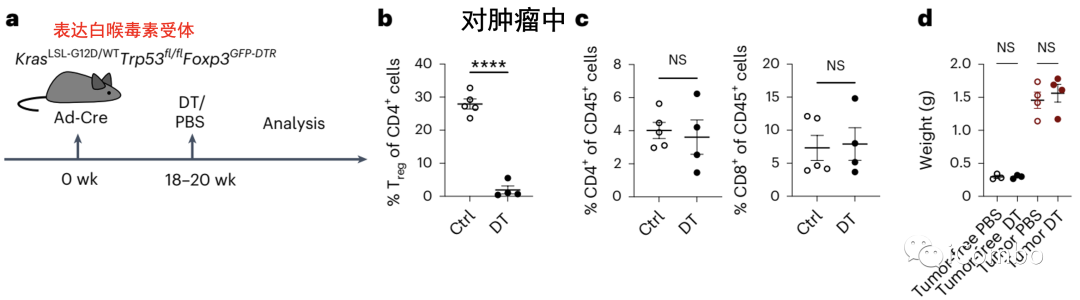
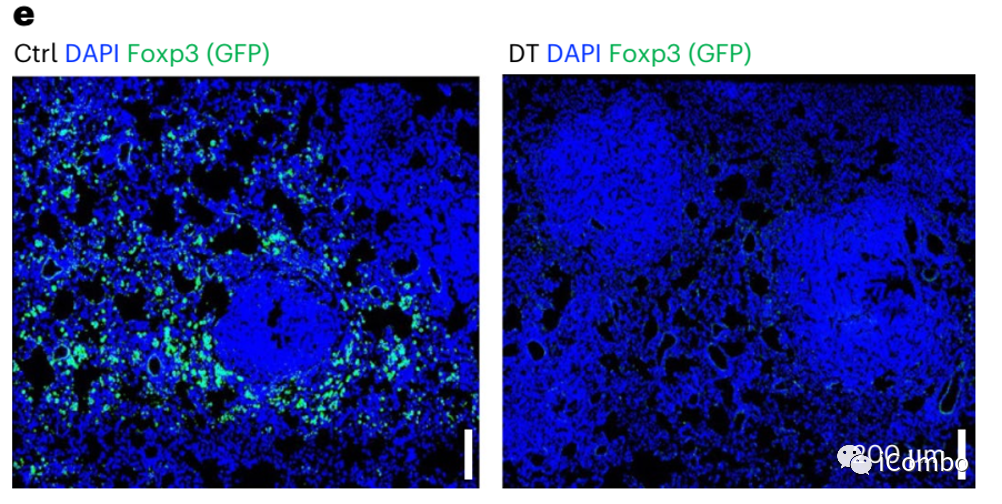
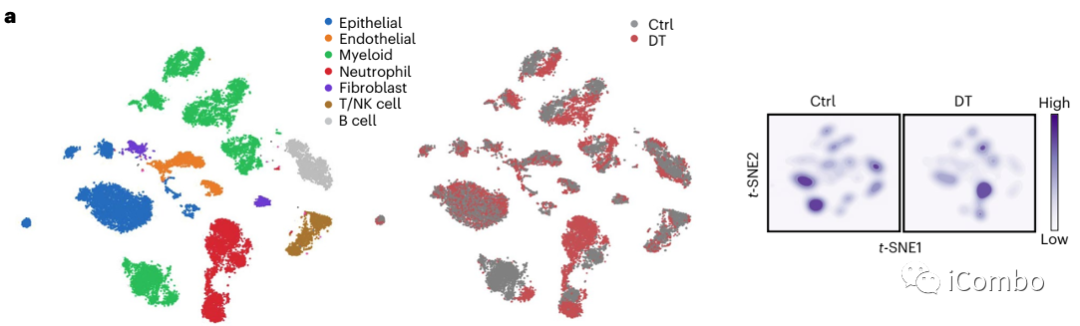
建立小鼠腺癌模型,利用白喉毒素(DT)可有效清除Treg细胞。在Treg清除后72-96小时,活化的T细胞会迅速扩增并诱导显著的炎症反应,因此研究观察在DT给药48小时后的早期TME中相关细胞变化的情况。
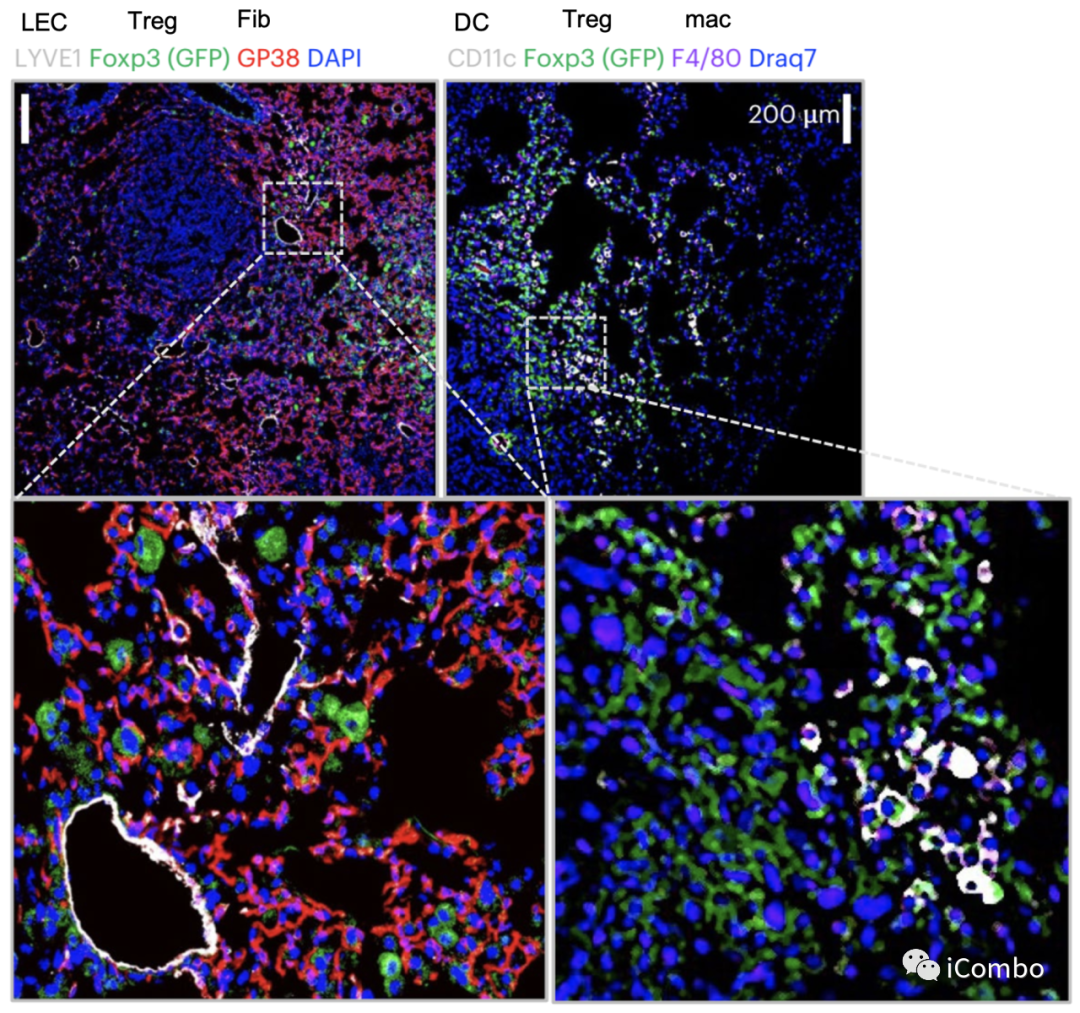
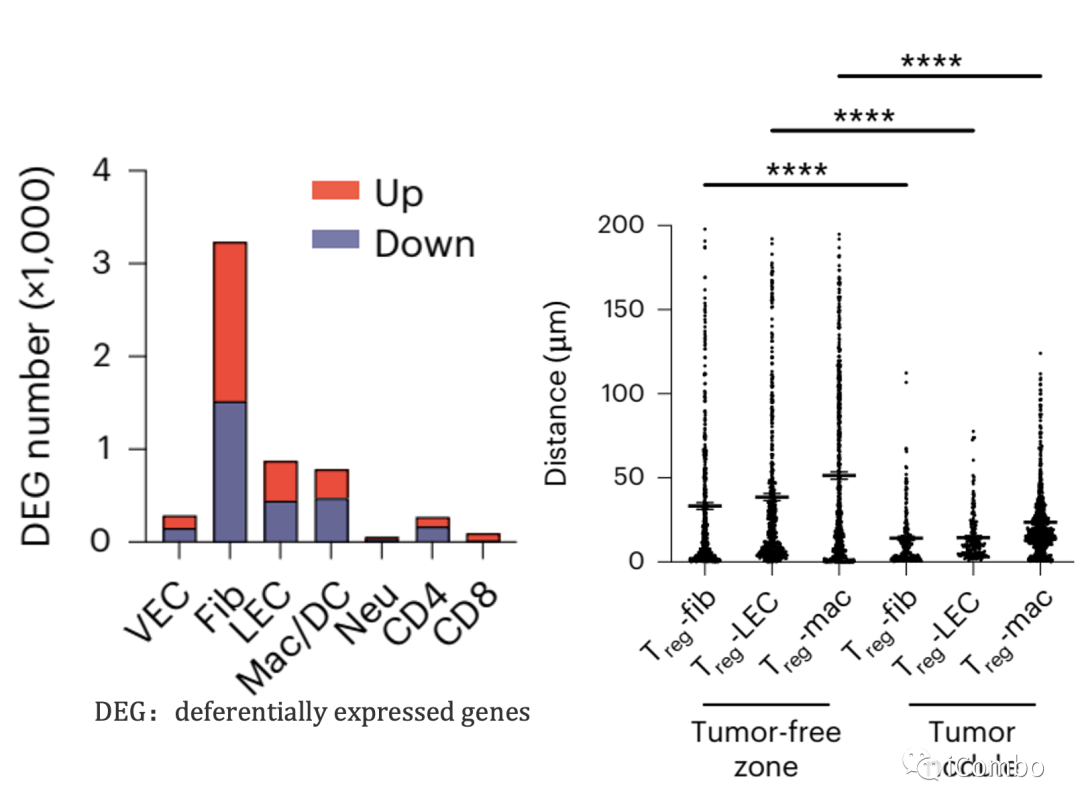
流式分选后RNA-seq显示荷瘤肺组织中淋巴内皮细胞(LEC)、成纤维细胞、巨噬细胞在Treg清除后基因表达变化最显著,并且这三种类型细胞与Treg的距离明显缩小,提示Treg与这些细胞间可能具有直接的相互作用。
研究结果2:单细胞测序分析Treg细胞的“连接性”
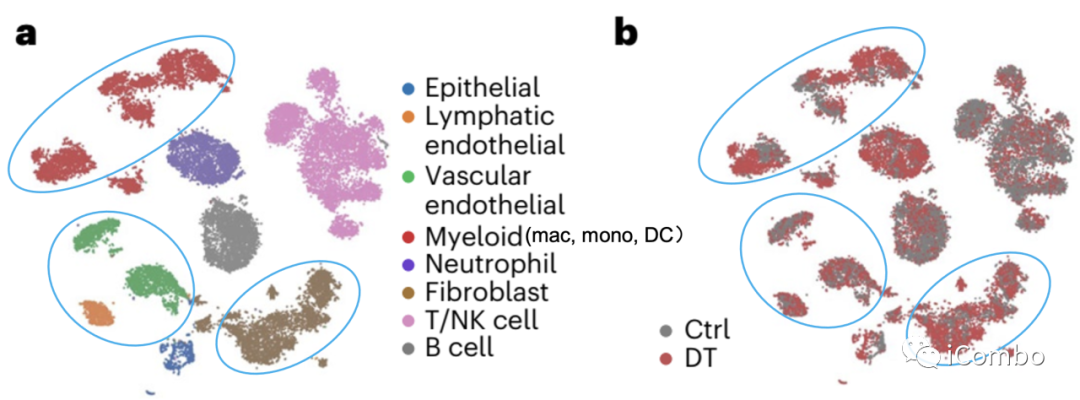
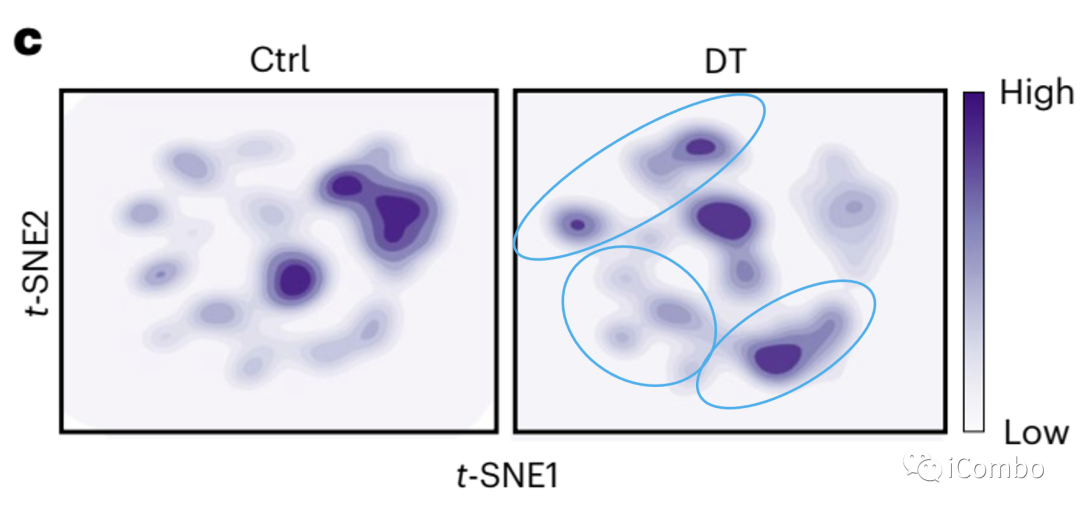
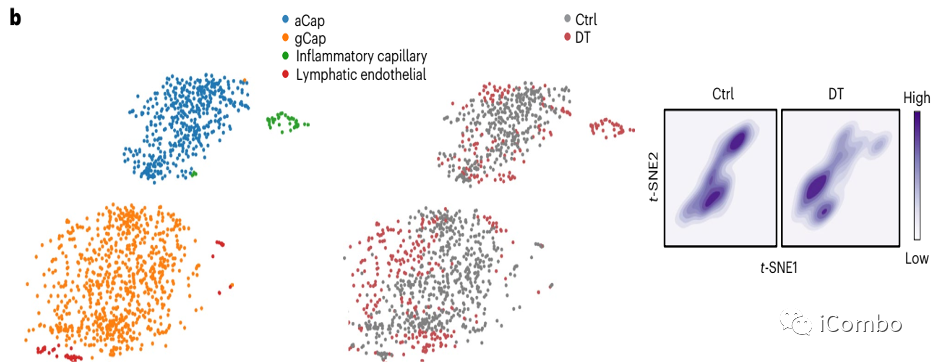
单细胞转录组测序(scRNA-Seq)聚类分析显示在Treg清除后成纤维细胞、髓系细胞和内皮细胞较淋巴细胞转录表型改变显著。
t-SNE(t-DistributedStochastic Neighbor Embedding, T 分布随机近邻嵌入)是一种可以把高维数据降到二维或三维的降维技术。
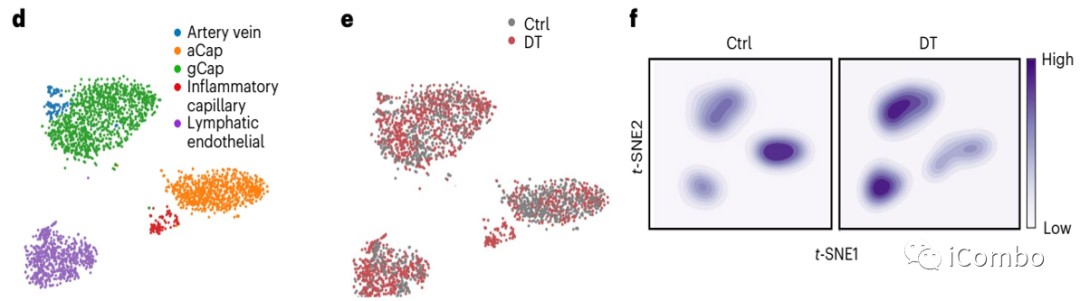
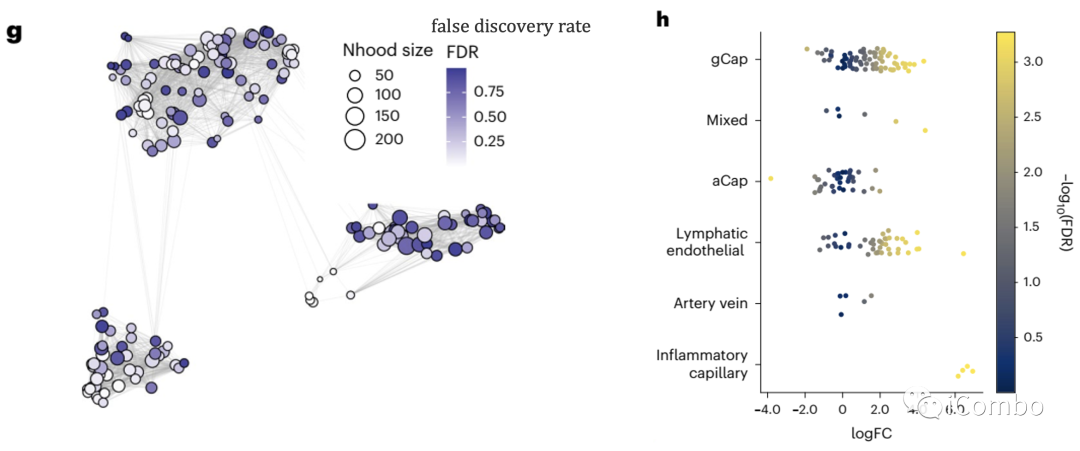
进一步细粒度分析显示部分细胞亚群改变显著:capillary VECs, mesenchymal stem cells (MSCs), Col14a1 matrix fibroblasts, monocytes and macrophages
不同内皮细胞类型中每个邻域中DT处理样品与对照样品中差异细胞类型丰度的对数倍数变化。每个点代表一个邻域,并通过FDR校正的P值(alpha=1)进行颜色编码,量化DT细胞富集与每个邻域的对照相比的重要性。如果邻域中包含某一细胞类型至少 80% ,则可将其归类,否则称为“mix”。
研究结果3:Treg清除后共同及特异性的基因差异性表达
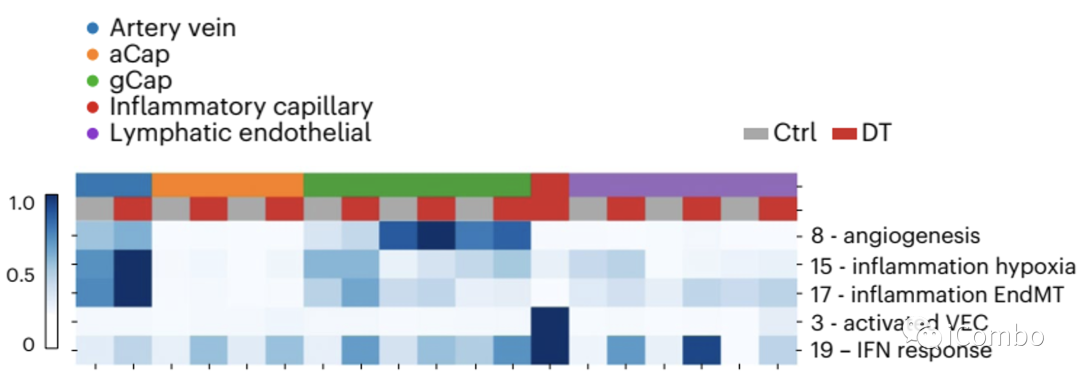
单细胞分层泊松分解(single‐cell Hierarchical Poisson Factorization, scHPF)用于在单细胞RNA测序数据中从头发现连续变化和亚群特异性表达程序。
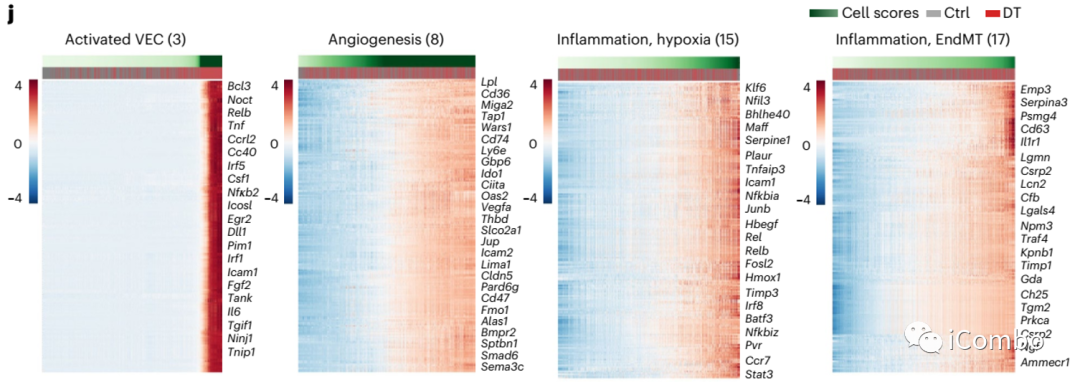
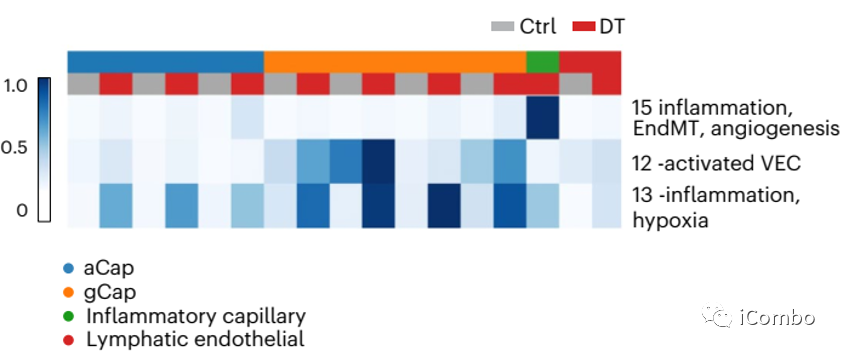
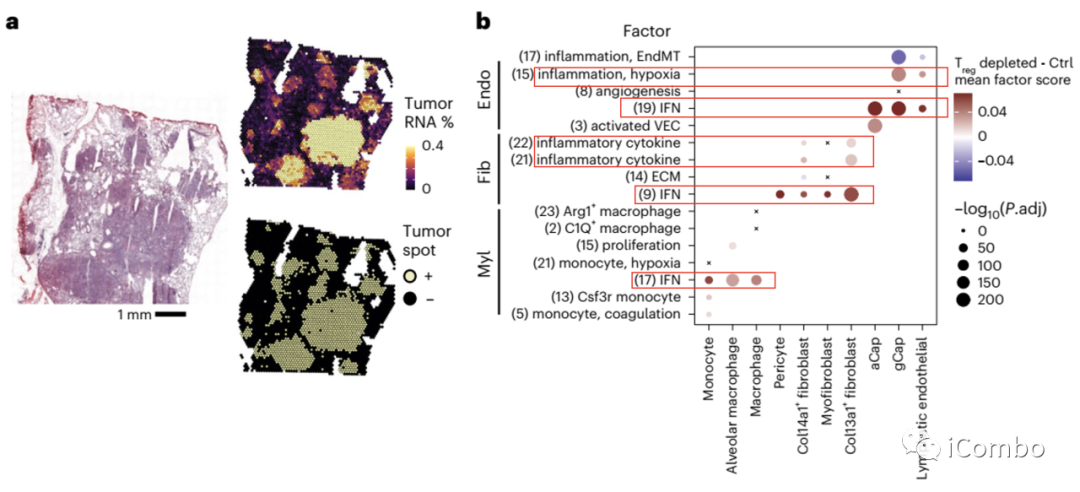
内皮细胞在Treg清除后4个主要的特征性基因表达程序:
inflammatory or activated capillary VEC factor (NF-κB signaling pathway (Nfkbia, Rel, Hbegf;factor 3), inflammation/hypoxia (Klf6, Serpine1, Plaur; factor 15) and vascularization (Vegfa, Thbd and Slco2a1; factor 8), transforming growth factor-beta-induced EndMT (Emp3, Timp1 and Tgm2; factor 17)
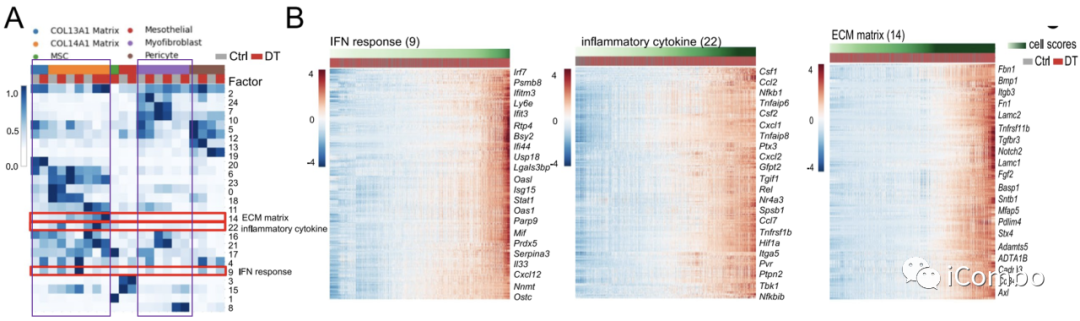
成纤维细胞有共同的基因差异性表达特征:inflammatory secretory phenotype (Ccl2, Hif1a, Rel, Cxcl1; factor 22), IFN response (Irf7, Ifit3, Isg15; factor 9) and ECM-related genes (Fbn1, Fn1, Lamc2, Notch2; factor 14)
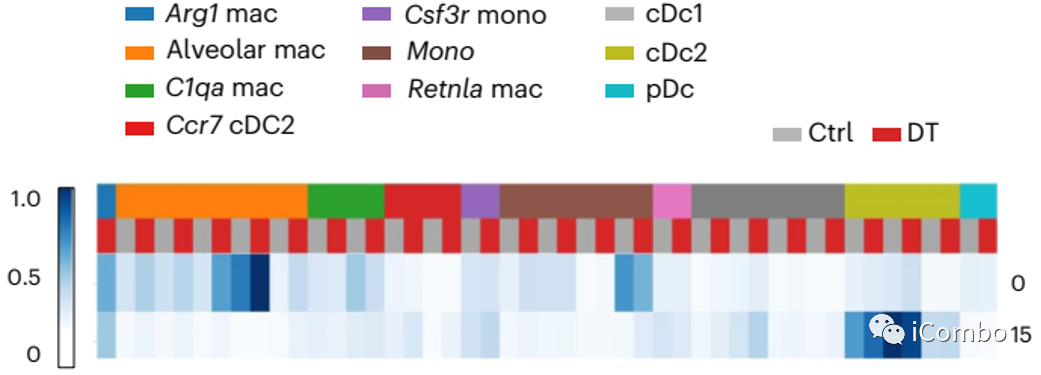
Treg清除后,多个细胞亚型有共同的基因差异性表达特征:interferon (IFN) response, inflammatory cytokines (ICs) and chemokines, STAT3 and interleukin (IL)-6 signaling
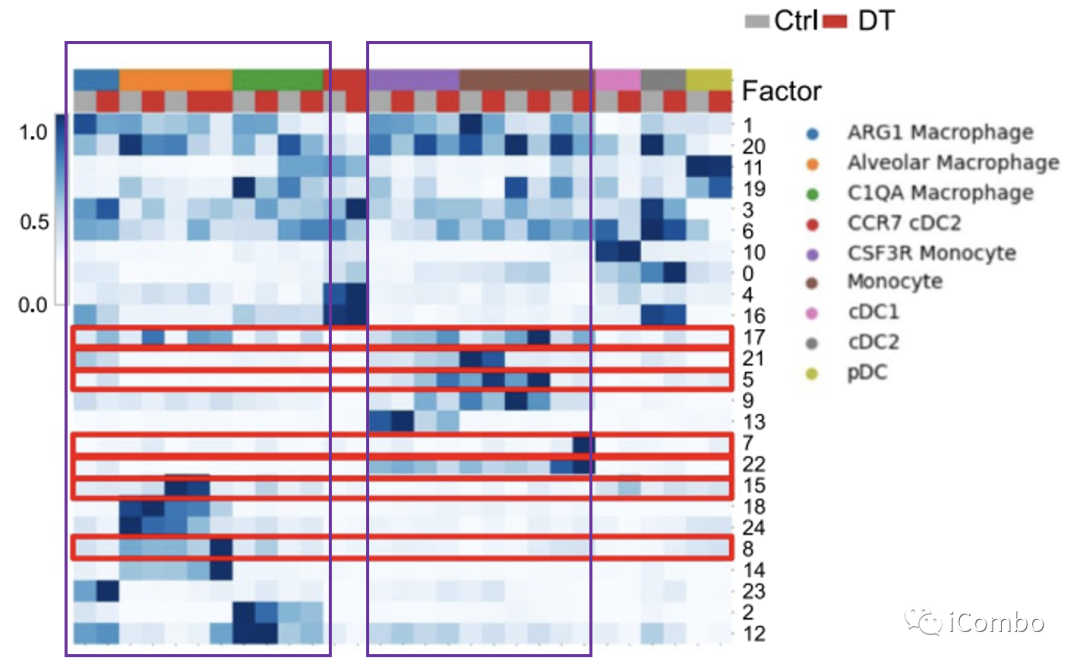
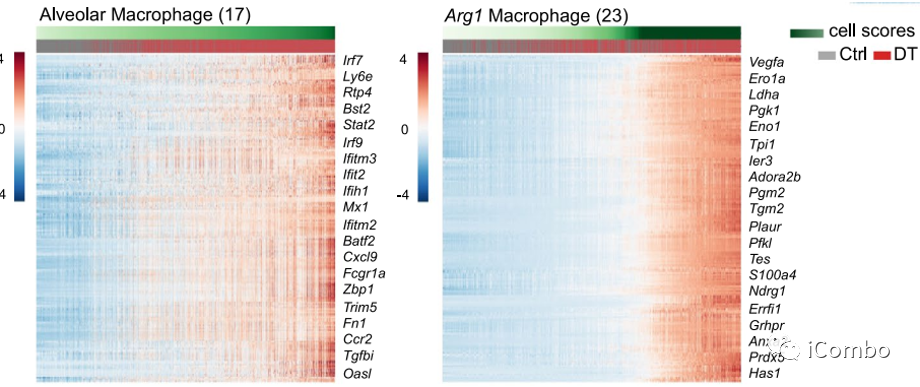
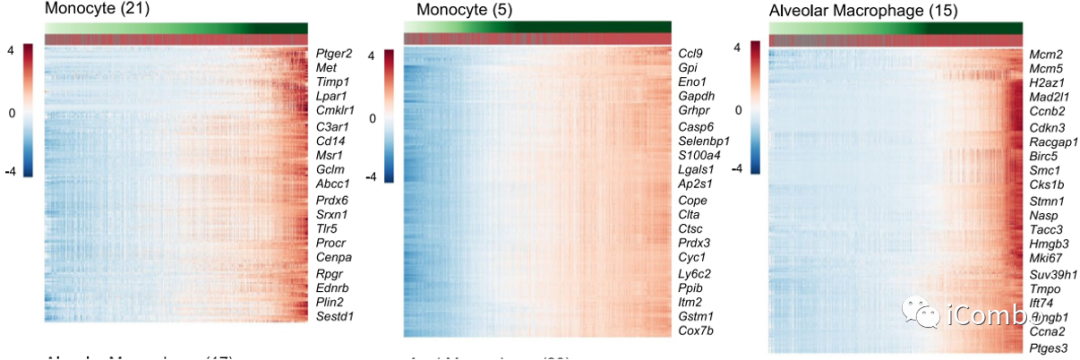
Treg清除后,多个细胞亚型有特异性的基因差异性表达特征:monocytes (factors 2, 5, 7, 13, 17, 21 and 22) and macrophages (factors 15, 17 and 23)
研究结果4:不同病理状态下共享的Treg依赖的转录组变化
博来霉素诱导的纤维化肺炎
研究结果5:TME中Treg依赖的基因表达的空间分布
空间转录组分析显示,inflammatory factor(IC)和IFN信号通路相关基因在内皮细胞和成纤维细胞中表达上调
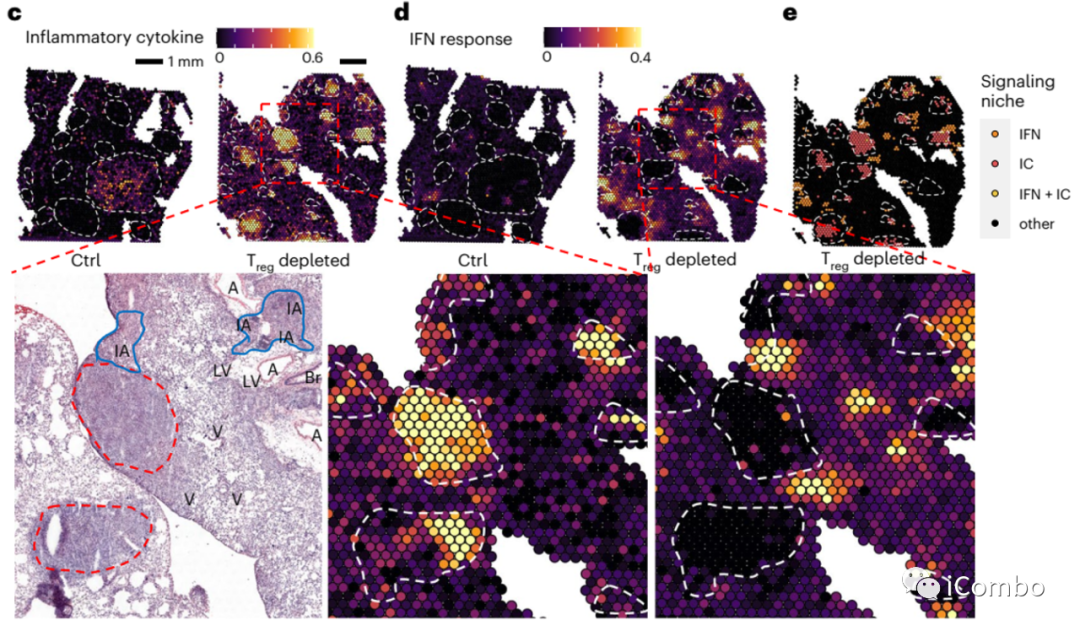
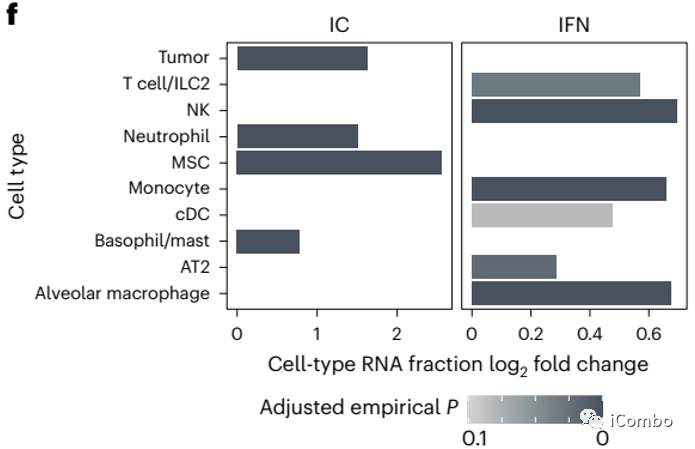
在Treg清除后,inflammatory factor(IC)和IFN信号通路相关基因表达在肿瘤病灶内和肿瘤边缘有不同的分布特征,IC主要分布在肿瘤病灶内,而IFN更多分布在肿瘤边缘或相距较远的位置。
研究结果6:Treg清除改变肿瘤细胞状态
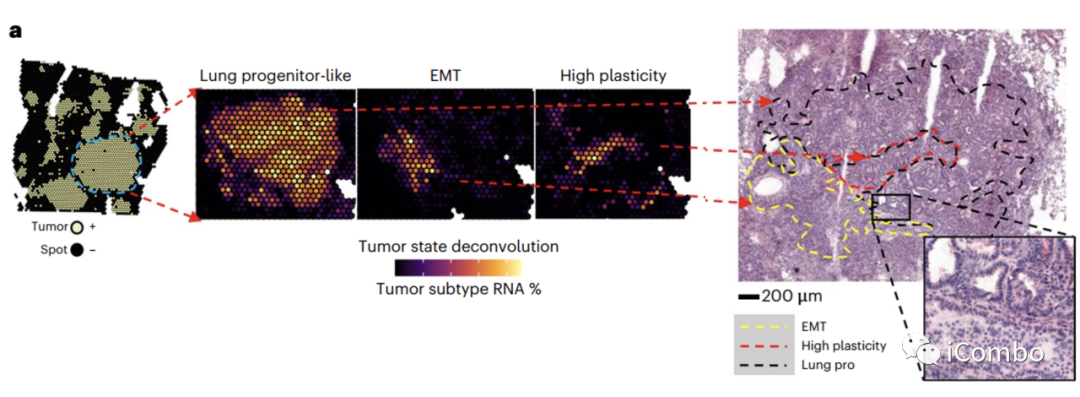
研究表明肺腺癌(LUAD)主要起源于肺泡2型(AT2)细胞亚群。在LUAD的基因改造小鼠模型中,KP型肿瘤在12周内发展为晚期LUADs。从正常的AT2细胞开始到完全形成的LUAD结束,随着肿瘤的发展细胞表型异质性增加。Waddington-OT算法,将细胞状态之间的转换的可能性建模,其中某一簇细胞与其他细胞状态的连接最为丰富和稳定,并包含高度混合的细胞,将这种细胞状态指定为高可塑性细胞状态(HPCS)。
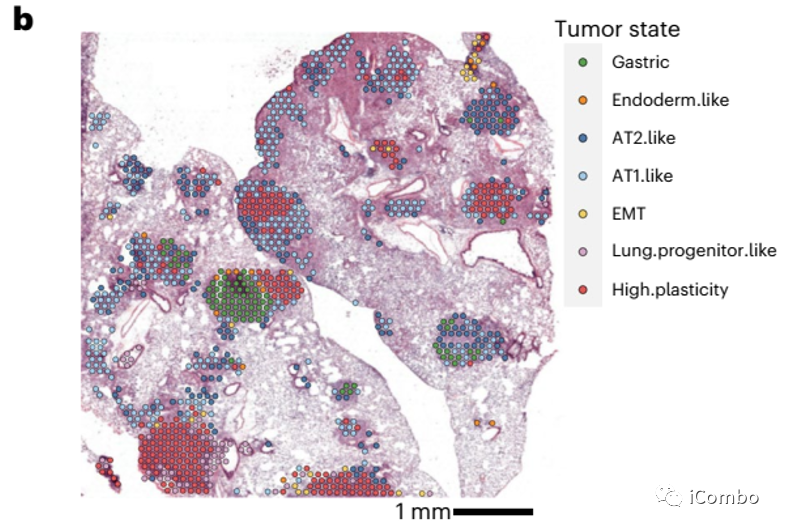
大多数出现腺癌的细胞具有肠和/或胃或胚胎肝上皮的特征,LUAD进化的特征是肺谱系保真度的丧失和其他相关特征的出现。
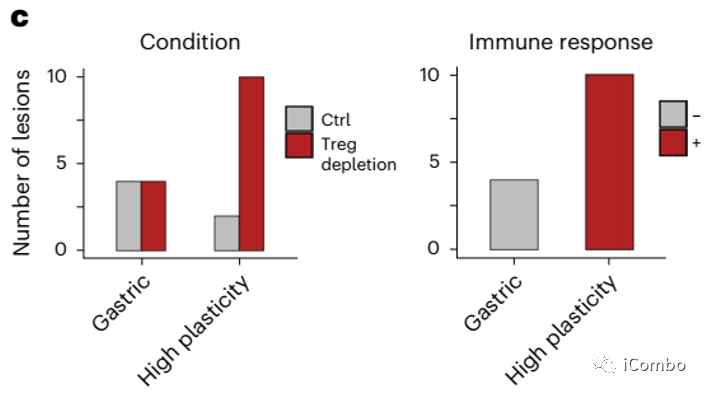
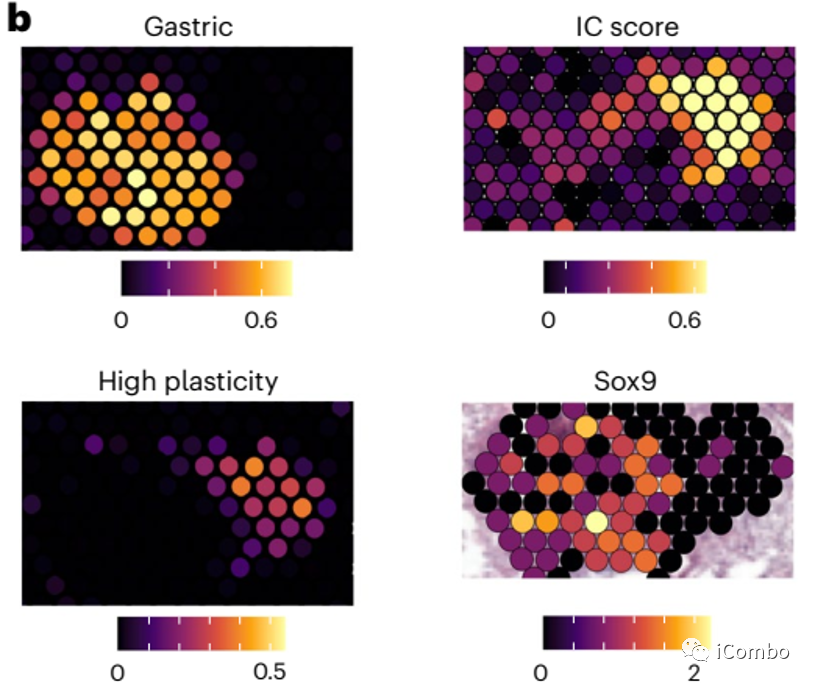
Treg清除后导致总体免疫治疗应答提高,但具有瘤内异质性:
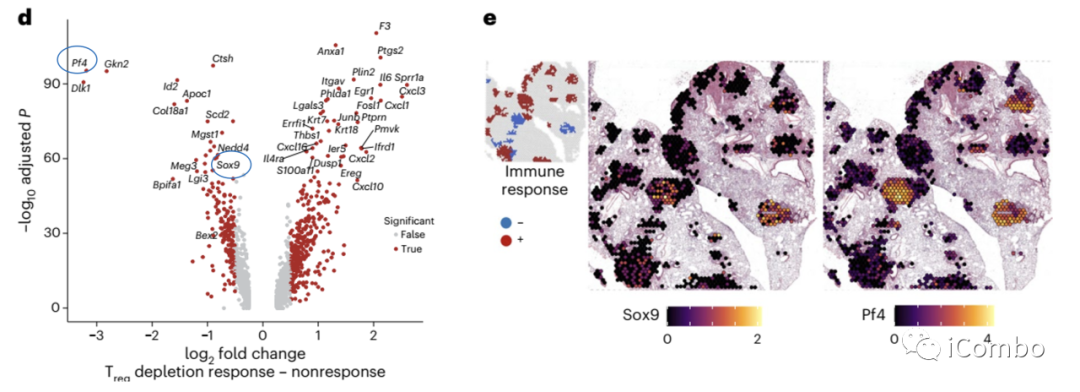
Sox9表达提示细胞可逃脱NK细胞的杀伤,促进免疫逃逸。
肿瘤衍生的血小板因子4(PF4,CXCL4)在非小细胞肺癌(NSCLC)患者中促进骨髓巨核细胞介导的血小板产生。治疗前血小板与淋巴细胞比率升高与nivolumab抗PD-L1免疫疗法的响应率降低相关。
研究结果7:Treg清除后免疫应答改变具有空间异质性
研究结果8:Treg清除导致TME改变在人源/鼠源肿瘤中具有保守性
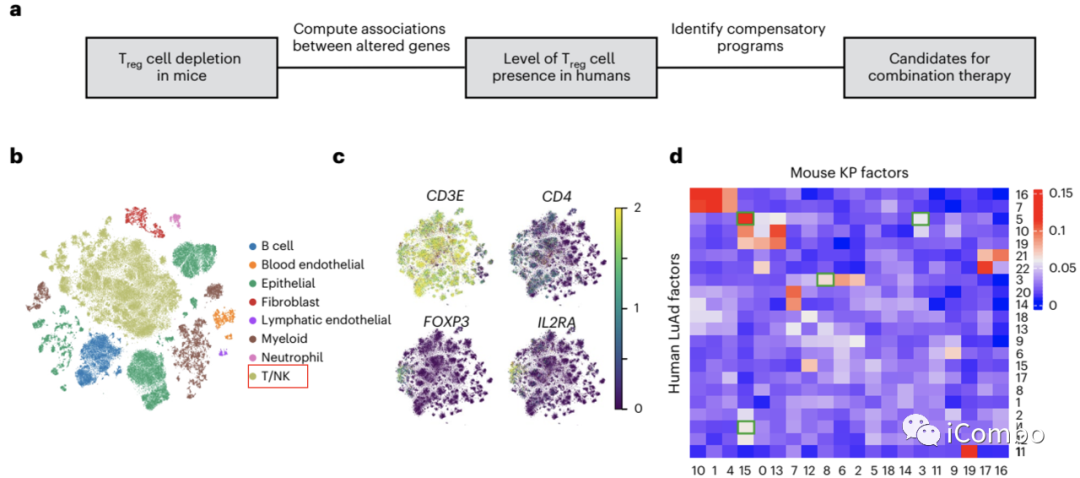
使用 scRNA-seq 分析人源的原发性或局部转移性 LuAd样品中的 Treg细胞。
分析人源和鼠源内皮细胞中的直系同源基因。
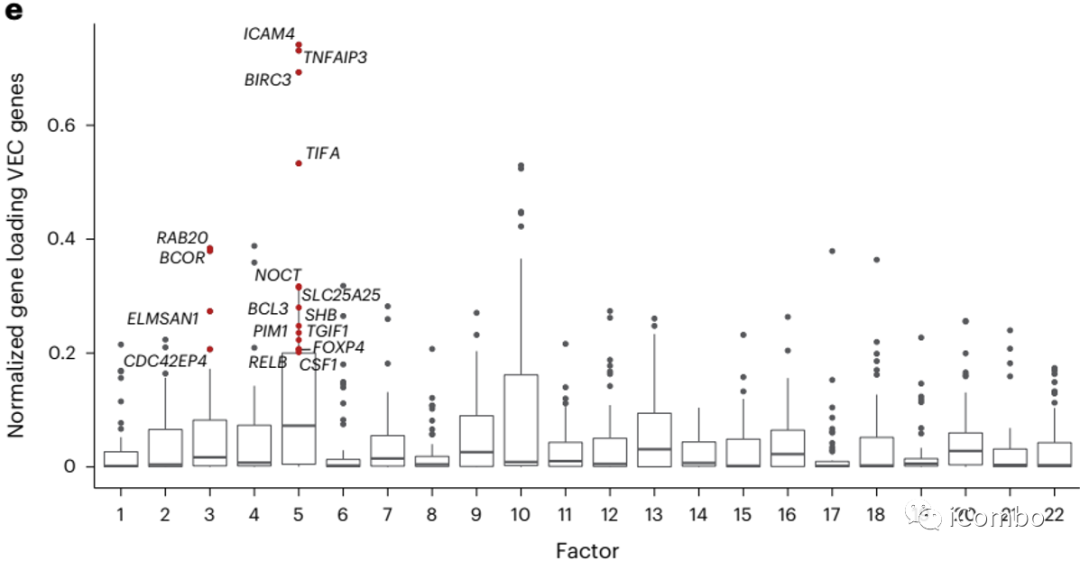
对人源肿瘤标本进行单细胞测序,对比小鼠模型中内皮细胞的基因,发现类似的特征性基因表达程序。
活化的 VEC 标记基因表达具有保守性:
activated aCap (factors 3 and 5)
inflammation and hypoxia (factors 4 and 5)
angiogenesis factors (factor 3)
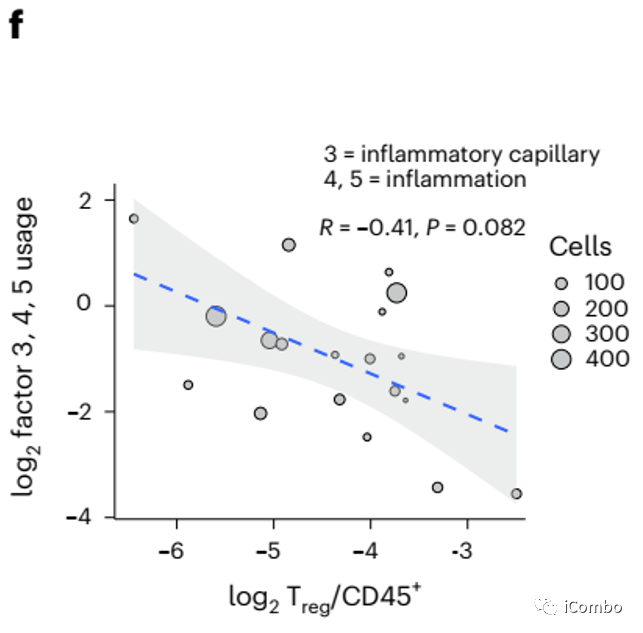
内皮细胞factor3,4,5与Treg比例具有负相关性。
对成纤维细胞和髓系细胞的类似分析也揭示了相似的 Treg 细胞依赖性小鼠和人源基因改变。
研究结果9:联合Treg清除的治疗策略
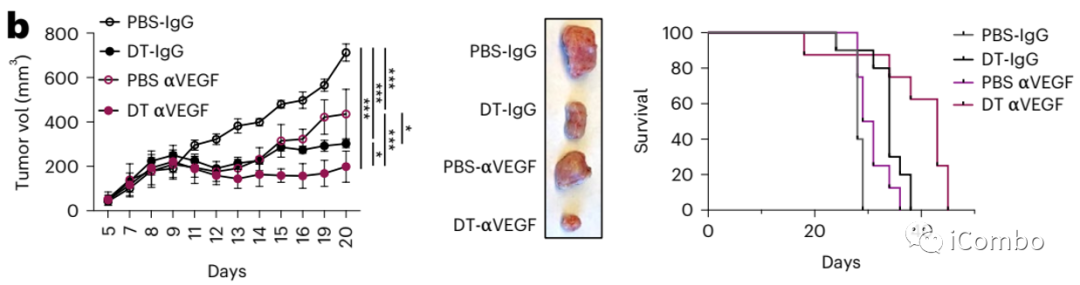
Treg清除后的“补偿”机制可作为临床联合干预的靶点。
联合Treg清除和抗血管治疗可明显提高抑瘤效应。
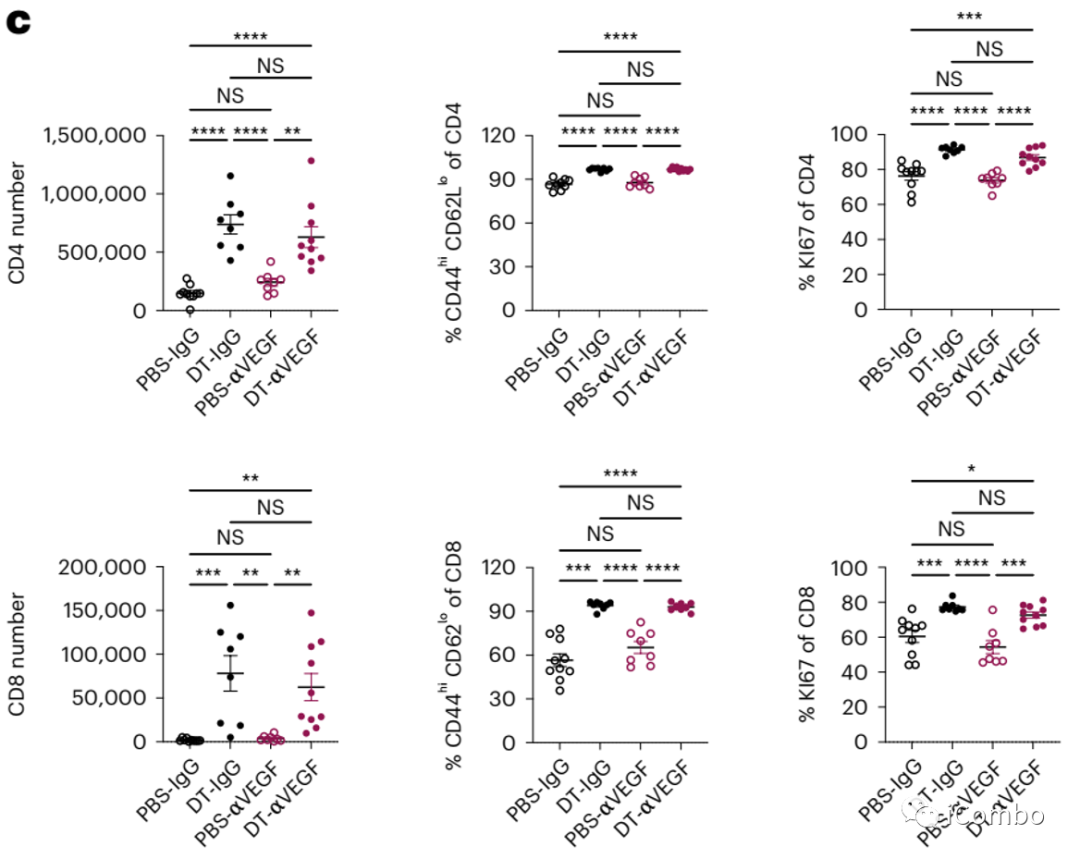
与aVEGF组相比,在DT+aVEGF组和DT组中观察到肿瘤T细胞的数量和活化水平有类似的增加。
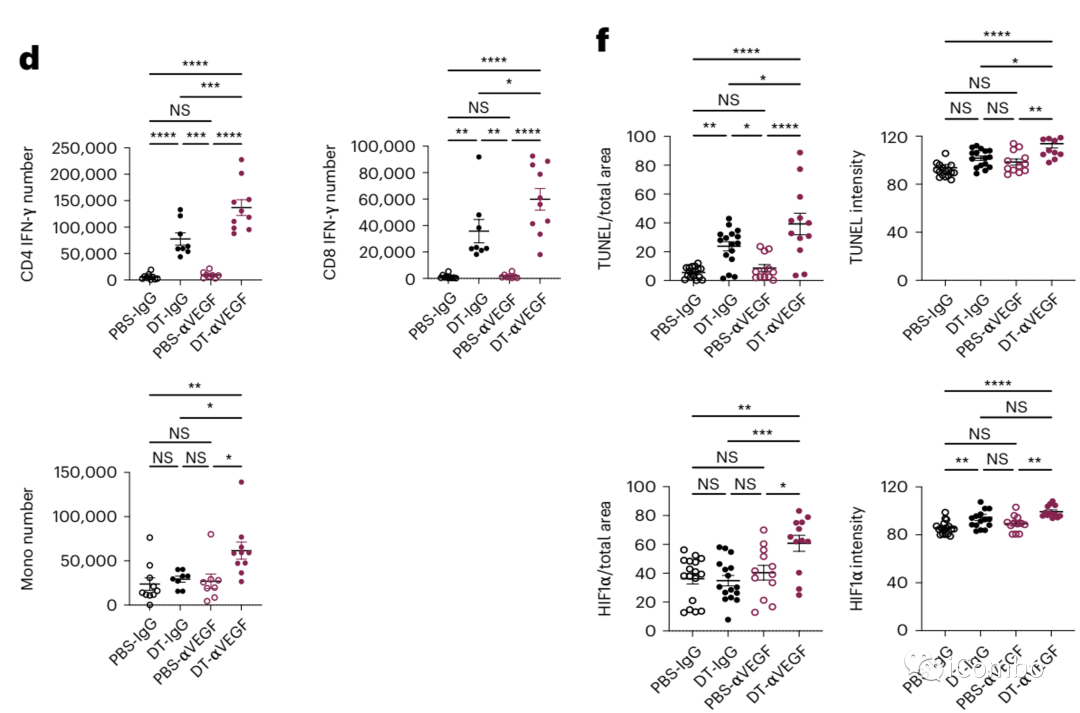
与单药处理组相比,在DT+aVEGF组中观察到IFN-g表达的CD4 T细胞和CD8 T细胞以及单核细胞的数量增加,肿瘤细胞凋亡和缺氧标志物也在联合组明显增加。
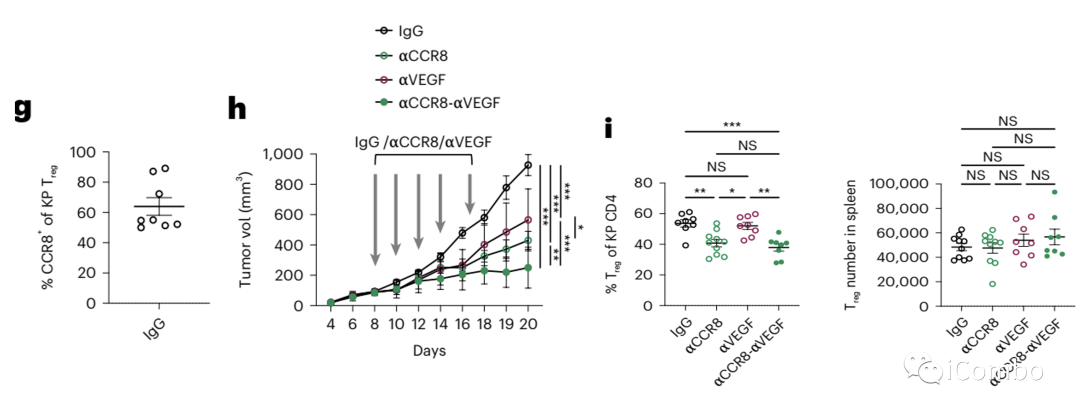
CCR8表达于部分瘤内Treg细胞,可作为清除Treg的靶点。
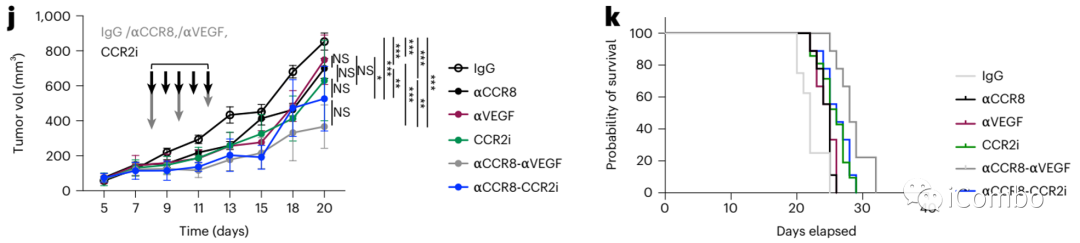
CCR2-CCL2也是Treg细胞清除后的补偿通路之一,可作为干预的靶点。
小结
1. Treg细胞是肿瘤微环境中造血和非造血来源的辅助细胞复杂网络中的重要组成部分。
2. 在不同疾病状态中观察到的细胞转录状态改变具有共同特征,Treg细胞和组织支持细胞网络之间的相互依赖具有保守性,可以据此来开发合理治疗肿瘤和其他疾病的新策略。
作者:iCombo
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言