Cell Metab:“糖有毒”!高血糖会导致每个β细胞每秒泄漏10万个ATP分子,胰岛细胞就是这样被活活饿死的
2019-01-27 奇点糕 奇点网
他们发现,2型糖尿病患者的高血糖水平,会导致生产胰岛素的β细胞变得“千疮百孔”,以至于单个β细胞在每秒钟的时间里,至少向周边组织环境中泄漏100000个ATP分子。
人类关于糖尿病的最早记载,始于公元前1500年的古埃及。
虽然在接下来的3500多年里,糖尿病从可怕的绝症变成了可防可控的慢性病,但是时至今日,我们对于糖尿病究竟是如何发生的依然知之甚少。
也正是这份无知,让人类对糖尿病少了几分敬畏。
瑞典隆德大学Albert Salehi团队发表在著名期刊《细胞代谢》上的研究成果,或许能给我们当头棒喝。
他们发现,2型糖尿病患者的高血糖水平,会导致生产胰岛素的β细胞变得“千疮百孔”,以至于单个β细胞在每秒钟的时间里,至少向周边组织环境中泄漏100000个ATP分子。
ATP是什么?它可是人体内最直接的能量来源。没有了它,一切生命活动终将停止。
生产降糖物质胰岛素的β细胞就是这样被活活饿死的。
很讽刺是不是?血液中充满了葡萄糖,β细胞却饿死了。
高血糖是有毒的。
Albert Salehi
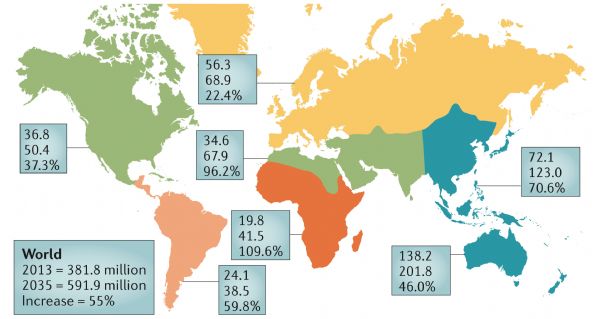
自1980年以来,糖尿病发病率在全球呈高速增长趋势。根据世界卫生组织首份《全球糖尿病报告》显示:截至2014年,全球成人糖尿病患者数量高达4.22亿,而1980年时这一数字还只是1.08亿。
大多数2型糖尿病继发于肥胖,以及肥胖导致的胰岛素抵抗。在这种情况下,为了降低血糖,β细胞只能开足马力生产更多的胰岛素来应对。在历经多年的前驱糖尿病的阶段之后,β细胞会逐渐不再生产更多的胰岛素去应对胰岛素抵抗,这时2型糖尿病就上身了。
2013年的糖尿病患者人数,以及2035年可能的人数
高血糖对人体的伤害,那可真是全身性的,例如β细胞和心血管系统,甚至大脑,这就是所谓的葡萄糖毒性。为了降低高血糖对身体的毒害,我们发明了二甲双胍降低血糖的来源;还找到了增强葡萄糖储存细胞对胰岛素敏感性的药物,或者刺激已经不堪重负的β细胞多合成胰岛素的药物;甚至还有阻止肾对葡萄糖重吸收的降血糖方法。
不过,上面的药物都不能有效地保护β细胞,也不能预防2型糖尿病。然而,以葡萄糖刺激的胰岛素分泌(GSIS)变弱为特征的β细胞功能紊乱,恰恰是2型糖尿病的主要问题。
我们需要搞清楚高血糖究竟是如何伤害了β细胞。
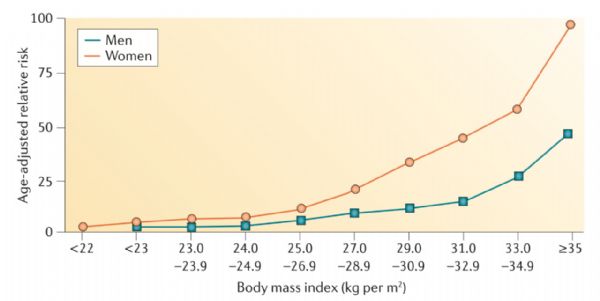
2型糖尿病发病风险与年龄和BMI之间的关系
Salehi和Wollheim团队的研究人员注意到,之前的研究表明,β细胞中线粒体功能的紊乱与2型糖尿病有关[9]。而在线粒体外膜上,电压依赖性阴离子通道(VDAC1)是最丰富的蛋白,它们甚至掌握着细胞的生死。
巧的是,在阿尔茨海默病的研究中,研究人员早就发现,在阿尔茨海默病早期,VDAC1就难逃干系,而且用VDAC1的抗体抑制VDAC1的活性,可以保护神经细胞免受淀粉样β(Aβ)肽诱导的神经毒性。
于是研究人员就想知道高血糖对β细胞的伤害是不是通过VDAC1实现的。如果是,这种伤害又是如何实现的,以及能不能被阻断。
这第一步,就是直接拿2型糖尿病供体的胰岛和没有糖尿病供体的胰岛做个比较。在mRNA和蛋白水平的比较发现,2型糖尿病供体的胰岛VDAC1的表达上调,在蛋白水平上也是同样的结果。如此看来,在2型糖尿病患者的体内,血糖水平与VDAC1之间是存在联系的。
为了在血糖水平与VDAC1之间建立更直接的联系,研究人员又尝试用不同浓度的葡萄糖处理离体培养的人胰岛细胞,观察葡萄糖毒性是否确实存在。
研究人员用足以导致β细胞出现GSIS的高浓度葡萄糖(20mM)处理胰岛细胞,发现这些胰岛细胞表现出了2型糖尿病的特征,VDAC1的表达水平确实上升;而经10mM的葡糖糖处理的胰岛细胞,VDAC1的表达水平没有变化。如此看来,β细胞的VDAC1过量表达确实是高血糖水平诱导的。
不过,奇怪的是,在非常低的葡萄糖水平(5mM)下,即使通过其他手段促进VDAC1高表达,也没有导致β细胞受伤。随后研究人员发现,只有在葡萄糖水平很高的情况下,VDAC1高表达才会损害β细胞的功能。
这表明,VDAC1高表达对β细胞的伤害与高血糖(葡萄糖毒性)是偶联的。而且研究人员最后发现,高血糖是通过表观遗传控制VDAC1的表达的。
下面一个问题是,VDAC1高表达怎么就伤害β细胞了呢?
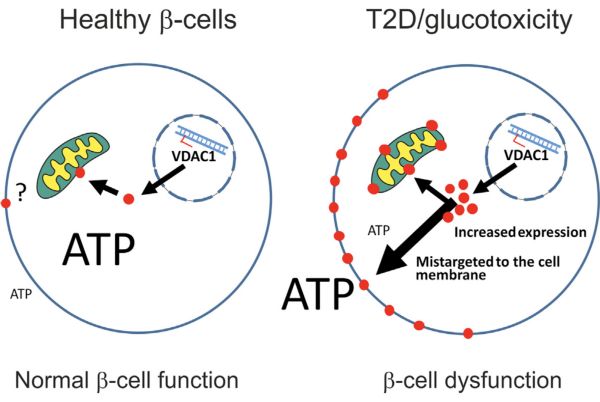
由于VDAC1是细胞膜上的通道蛋白,所以研究人员决定看看过量表达的VDAC1都跑到哪里安家去了。
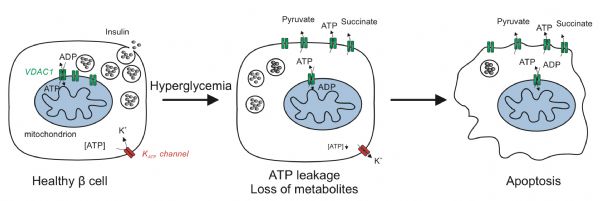
之前的研究已经表明,VDAC1离子通道蛋白主要定位在线粒体外膜上,它主要功能是调节线粒体的体积、从线粒体里往外转运ATP等代谢产物。对于维持线粒体和细胞的稳定非常重要。
不过,当研究人员给2型糖尿病供体中获取的β细胞中的VDAC1离子通道蛋白加上荧光标记之后,却意外地发现,这个本该在线粒体外膜上安家的通道蛋白,大量定位在β细胞的细胞膜上了!
这样的话,肯定会导致ATP等代谢产物从β细胞中大量外泄啊~~
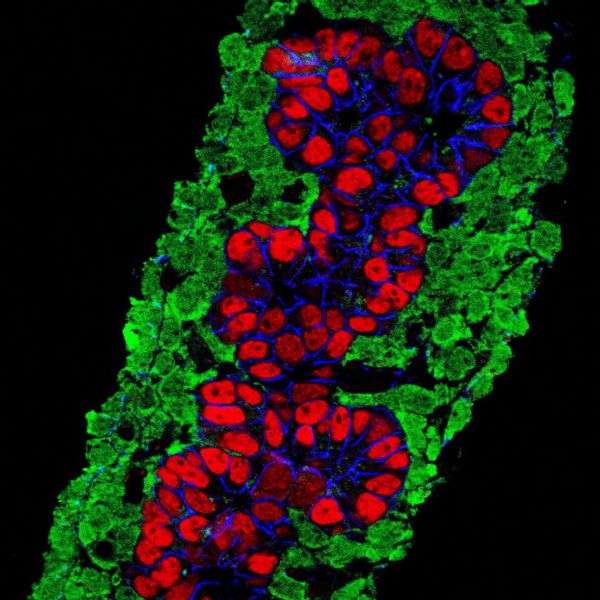
左边是健康的β细胞,右边是深受高血糖毒害的β细胞;小红点是VDAC1通道蛋白
研究人员有点儿不相信自己的眼睛。
他们从2型糖尿病供体和非糖尿病供体的胰岛中,取出相应组织染色,发现在2型糖尿病供体的胰岛中,β细胞表面确实出现了大量本不该出现的VDAC1离子通道蛋白。
研究人员很快又在体外培养的人β细胞中发现了类似的现象。
难不成2型糖尿病患者的β细胞最终是被活活饿死的?
为了证实这个结果,研究人员进一步分析了VDAC1离子通道蛋白在β细胞表面安家对β细胞的影响。结果证实了他们的猜想,大量的ATP从β细胞中外泄。此时的β细胞犹似被“万箭穿心”,体内的能量顺着万千孔洞往外泄……
据研究人员评估,每个β细胞每秒钟至少要向细胞外泄露100000个ATP分子!
显然,ATP如此高速外泄,再加上高血糖带来的葡萄糖毒性的影响,β细胞肯定是撑不了太久的。
在我眼中,β细胞变成这样了
既然原因已经找到了,那这还有没有得治呢?
实际上,在研究人员分析2型糖尿病供体的样本时就发现,二甲双胍似乎可以解围。后来经过确认,研究人员发现,二甲双胍确实可以通过抑制VDAC1离子通道蛋白的活性,帮助β细胞解围。
这也是科学家首次发现二甲双胍还可以通过这个途径降血糖。实际上,近来也有研究表明,二甲双胍降糖不是通过改善胰岛素的分泌,而是保护β细胞。恰恰与本研究暗合。
二甲双胍这一新功能的发现让人欣喜。由于VDAC1离子通道蛋白与阿尔茨海默病之间的关系,二甲双胍既然可以抑制VDAC1离子通道蛋白的活性,那么或许二甲双胍对阿尔茨海默病也有一定的保护或治疗效果也未可知。
虽然科学家在这里发现了一个可以保护β细胞的新靶点,但是在针对这个靶点的药物要走向临床还有很多研究要做。距离患者用上药,恐怕还有很长的时间。
原始出处:Zhang E, Alamily I M, Mohammed S, et al. Preserving Insulin Secretion in Diabetes by Inhibiting VDAC1 Overexpression and Surface Translocation in β Cells. Cell Metabolism, 2018.
作者:奇点糕
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#CEL#
37
#MET#
34
#胰岛细胞#
48
#Cell#
39
#Meta#
45