黑色素细胞性皮肤肿瘤的治疗研究进展
2022-07-11 mirza MedSci原创
近日发表在《Medicine - Programa de Formación Médica Continuada Acreditado》杂志上的一篇文章广受关注,来自西班牙
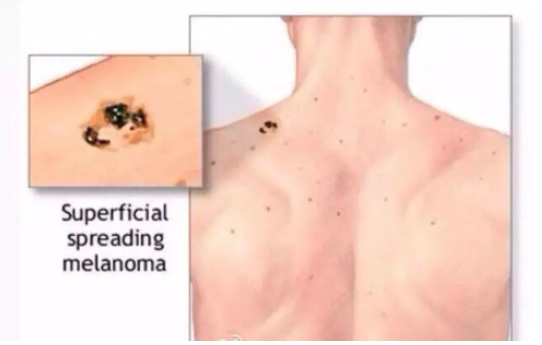
近日发表在《Medicine - Programa de Formación Médica Continuada Acreditado》杂志上的一篇文章广受关注,来自西班牙的一支研究团队团队对黑色素细胞性皮肤肿瘤的治疗研究进展 开展了相关研究。 黑色素瘤是一种来源于转化黑素细胞的恶性肿瘤,发病率在全球范围内持续上升。尽管黑色素瘤与其他皮肤癌相比并不常见,但其死亡率更高,约占皮肤癌相关死亡病例的73%,死亡的主要原因是广泛转移到淋巴系统和其他重要器官[3]。皮肤黑色素瘤(cutaneous melanoma,CM)的Ⅰ~Ⅳ期 5 年生存率分别为 97%(ⅠA 期)、84%(ⅠB 期)、68%(Ⅱ期)、55%(Ⅲ期)、17%(Ⅳ期)[4]。黑色素瘤也不仅可以侵犯皮肤,还可能出现在任何正常黑素细胞可能出现的其他部位,例如眼部、胃肠道、泌尿生殖系统和鼻咽部等。 CM主要有 4 种亚型,分别为浅表播散型、结节型、恶性雀斑样痣型和肢端雀斑样痣型;西欧高加索人种主要以浅表播散型为主(约占 CM的 70%),而肢端雀斑样痣型黑色素瘤(acral lentiginous melanoma,ALM)却在我国最为常见。黑色素瘤预后极差,早期易转移,除化疗外,生物治疗、靶向治疗和放疗是其他广泛应用于黑色素瘤治疗的辅助疗法。然而,由于敏感度差、毒副作用强、抗药性强,这些治疗方法的疗效有限,需要探索新型有效的方法来应对逐渐进展的黑色素瘤。现就黑色素瘤目前在手术、免疫和靶向治疗等方面的进展做出了综述。 1 手术治疗 手术仍是黑色素瘤的主要治疗方式,特别是早期黑色素瘤,大部分可通过手术实现治愈。 早期黑色素瘤在活检确诊后应尽快做原发灶的扩大切除手术,要求切除完整的皮肤及深达肌筋膜的皮下组织。扩大切除的安全切缘是根据病理报告中的肿瘤浸润深度(Breslow 厚度)来决定的: ⑴浸润深度≤1 mm 时,安全切缘为 1 cm; ⑵浸润深度>1~2 mm 时,安全切缘为 1~2 cm; ⑶浸润深度>2 mm 时,安全切缘为 2 cm。 对于活检病理未能报告浸润深度或者病灶巨大的患者,可以考虑直接扩大切除2 cm。一般无需切除筋膜,但对于浸润较深(>4 mm)的原发灶可以考虑切除筋膜。 前哨淋巴结活检(sentinel lymph node biopsy, SLNB)对判断分期和预后很重要,也是判断区域淋巴结状态的重要手段。SLNB 阳性的患者需要接受辅助系统治疗,从而减少疾病复发的可能性。Morton 等证实了 SLNB 对分期和预后的指导意义,他们认为,通过前哨淋巴结(sentinel lymph node,SLN)早期识别肿瘤的微转移,然后对SLNB阳性的患者进行完整的淋巴结清扫(completion lymph- node dissection,CLND),可以防止肿瘤进一步扩散,从而提高生存率。 但SLNB 阳性后即刻行 CLND 是否优于观察到淋巴结进展后再行晚期治疗性淋巴结清扫(therapeutic lymph node dissection,TLND)一直存在争议。多中心选择性淋巴结切除术试验 (MSLT- II 试验)也显示,在黑色素瘤特异性生存、无病生存率(disease- freesurvival,DFS)、OS 方面,CLND 组和观察组之间的差异无统计学意义(P>0.05),且 CLND 组中 24.1% 的患者发生淋巴水肿,而观察组(仅 SLNB)只有 6.3%,但观察组的非前哨淋巴结(nonsentinel lymph nodes,NSLN)复发率较高。 这两项研究均未显示出任何生存益处,因此指南不再推荐 SLNB 阳性的患者接受常规的 CLND。然而,这两项研究的结论受到总体上 SLN 疾病负荷较低的研究人群的限制,需要特别关注那些确实有较高风险的疾病,对于 SLN 肿瘤负荷超过 1 mm 的患者,CLND 可能仍然具有改善预后和治疗的作用。 2 免疫治疗 黑色素瘤是一种免疫原性的肿瘤,但是使用化疗等传统的癌症治疗方式疗效却并不明显。目前在其发生的分子机制和信号通路方面也取得了显著进展,免疫治疗或许可以给未来黑色素瘤治疗的带来曙光。 高剂量白细胞介素 - 2(interleukin- 2,IL- 2)是首个被批准用于治疗不可切除的转移性黑色素瘤的免疫治疗剂。它不是检查点抑制剂,而是一种直接促进 T 细胞增殖和抗肿瘤活性的细胞因子。Atkins 等研究发现,只有在经过高度筛选的患者中可观察到高剂量 IL- 2 作用的持久完全应答,同时耐受与其相关的严重毒性呈现出较好的水平,且均为暂时性和可逆的,停止治疗后可很快消失。但在这一人群中也只出现了 16%的客观应答率(objective response rate, ORR)。 此外,有研究称主要由Th9 细胞(CD4+Th 细胞的一个亚群)分泌的 T 细胞和肥大细胞生长因子 IL- 9可以抑制体内黑色素瘤的生长。IL- 9 在体内通过激活固有免疫和适应性免疫应答,以及 Th9细胞可能的针对黑色素瘤的直接细胞毒副作用而发挥抗肿瘤的作用,这为探究免疫治疗的靶点提供了一个新的方向。 干扰素(interferon,IFN)是一种具有抗病毒、抗肿瘤和免疫调节作用的细胞因子。有文献报道了 IFN- α- 2b 作为辅助治疗的疗效,高剂量 IFN- α- 2b 在美国已经被批准可用于ⅡB 和Ⅲ期黑色素瘤的辅助治疗,然而中性粒细胞减少、肝脏毒性和导致疲劳等不良反应也不可忽视。因此,尽管IFN- α 作为黑色素瘤治疗辅助剂的益处在文献和临床试验中得到了很好的证明,但由于缺乏对确切机制的了解和其相当大的系统毒性,且给药剂型、给药时间和最佳剂量仍在探索中,可以有选择性地使用。 聚乙二醇(polyethylene glycol,PEG)- IFN- α- 2b 是一种长效干扰素。有学者报道了 EORTC18991 试验在 RFS 方面的显著优势,但在 OS 和 DMFS 方面无明显差别。虽然其在2011 年被批准治疗高危Ⅲ期术后黑色素瘤,但是国内仍然缺乏有效的临床研究数据。 CTLA- 4 是 T 细胞上的一种跨膜受体,与其配体 B7 分子结合后诱导 T 细胞无反应性参与免疫反应的负调节,引起对肿瘤细胞的免疫耐受。抗 CTLA- 4 机制在于,阻断效应 T 细胞上的负性调节受体 CTLA- 4 与其配体 B7 在抗原呈递细胞上的相互作用。Ipilimumab 是一种人类免疫球蛋白 G1 单克隆抗体,因随机试验发现其与使用疫苗或化疗相比,生存率有所提高,于 2011 年被获得批准使用。 Ipilimumab 最常见的免疫相关不良事件(immune- related adverse events,irAEs)是皮疹、结肠炎、肝炎和内分泌疾病等。特别在接受 3 mg/kg 与 10 mg/kg 剂量的患者之间观察到了差异:与治疗相关的严重不良反应发生率分别为 18.0%和 37.0%,可见 ipilimumab 3 mg/kg 剂量更加安全。ipilimumab 于 2015 年被批准用于Ⅲ期黑色素瘤术后的辅助治疗,然而 ipilimumab组和安慰剂组分别有 41.6%和 2.7%的患者发生 3 级或 4 级irAEs[17]。因此,高剂量(10 mg/kg)ipilimumab 在 RFS、OS 和DMFS 方面虽有显著的益处,但因其高毒副作用而导致其使用受限。目前正在研究较低剂量的 ipilimumab,以便在与其他药物联合使用时,可以在疗效和安全性之间达成更合适的平衡。 总之,这些研究证实,对于无法切除的转移性黑色素瘤患者,抗 PD- 1 治疗是首选的初始单药免疫治疗。
丝裂原活化蛋白激酶 (mitogen- activated protein kinase,MAPK)途径是一种复杂的信号通路,参与多种细胞功能,包括增殖、分化、细胞存活和应激反应。
在生理状态下,MAPK 级联首先由细胞外信号分子与受体酪氨酸激酶结合启动,随后刺激几个下游蛋白的连续磷酸化和激活。第一个是 GTPases (GTP hydrolases, GTP- binding proteins)的RAS家族(NRAS,KRAS,HRAS),随后激活 RAF 激酶家族(ARAF、BRAF、CRAF)。RAF 激酶结合并磷酸化 MEK,然后激活效应激酶 ERK,最终促进细胞核内的成活和增殖。大约 50%的黑色素瘤含有 BRAF 基因激活点突变,主要位于V600 密码子,其中最常见的为 V600E 突变,其次为 V600K突变。
迄今为止,具有最多临床数据的是使用 Ulixertinib(BVD- 523)的Ⅰ期试验,由于受不良反应的影响,相当一部分患者在治疗期间需要减少剂量(65.0%)。目前还不清楚涉及 MAPK 通路的某些驱动因素是否突变及如何最终影响患者对这些药物的反应,因此很难确定哪些患者应该纳入临床研究。
4 联合治疗
5 结语
首先,克服靶向治疗中的获得性耐药性和免疫治疗中的内在耐药性仍然是治疗的关键挑战,需要多学科结合来寻求解决途径。其次,分子领域的研究也给黑色素瘤治疗提供了新的方向,如微小 RNA、Toll 样受体等,同时一些如MSV/Trp2- CM疫苗等已在动物模型上取得了初步成效,新的癌症疫苗也是未来黑色素瘤治疗的发展方向之一。最后,联合治疗和新辅助治疗有较好的应用前景,但仍需解决药物的毒性反应和寻求最佳的治疗方案。
参考文献:
[1]CARR S, SMITH C, WERNBERG J. Epidemiology and risk factors of melanoma[ J ]. Surg Clin North Am, 2020,100(1):1- 12.
[2]GERSHENWALD J E, Jr GUY G P. Stemming the rising incidence of melanoma: calling prevention toaction [J].JNatl Cancer Inst, 2015,108(1):djv381.
[3]ZHU Z, LIU W, GOTLIEB V. The rapidly evolving therapies for advanced melanoma—Towards immunotherapy, molecular targeted therapy, and beyond[ J ]. Crit Rev Oncol Hematol, 2016,99:91- 99.
[4]AUBUCHON MM F, BOLT L J J, JANSSEN- HEIJNEN M L G, et al. Epidemiology, management and survival outcomes of primary cutaneous melanoma: aten- year overview[ J ]. Acta Chir Belg, 2017,117(1):29- 35.
往期推荐
作者:mirza
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#色素#
49
#皮肤肿瘤#
54
#细胞性#
54
#研究进展#
51
#黑色素#
36