Nat Commun:上海生科院发现组蛋白去乙酰化在小鼠神经诱导中的作用
2015-04-27 佚名 上海生命科学院
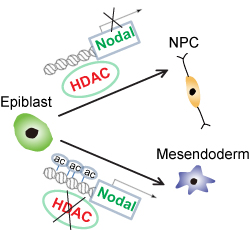
4月23日,国际学术期刊Nature Communications在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所景乃禾研究组的最新研究成果Histone deacetylation promotes mouse neural induction by restricting Nodal-dependent mesendoderm fate。该工作成功揭示了组蛋白去乙酰化在小鼠神经
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
32
#COMMUN#
35
#上海生科院#
26
#组蛋白#
30
厉害
96